CDAD②: 検査 CDAD③: 治療
C. difficle (Lancet Infect Dis 2005;5:549-57)
健常人では1-4%が常在菌として存在.
入院患者では15-35%のColonization (Lancet Infect Dis 2009;9:237-44)
腸内floraがC. diffのColonizationを阻害しており, Toxin産生も抑制している
抗生剤や, 加齢, もしくは新生児でFloraが乱れることで, C. diffのColonization阻害作用が減弱 ⇒ CD colitisを発症する.
上記以外には, 大腸ファイバーの前処置, 化学療法, IBDもRisk. (JAMA 2009;301:954-62)
Antibiotic-associated Diarrheaの 10-25%
Antibiotic-associated Colitisの 50-75%
Antibiotic-associated Pseudomembranous Colitisの 90-100%
CDADの死亡率は細菌の毒性変化に伴い上昇し, 6-12%.
英国では死亡250例の内, 1名がCDACによる (BMJ 2009;338:b1563)
年々頻度が増加し, 最近10年で3倍となっている
80-90 Case / 100 000人
Outbreakも増加しており, Quebecでは2002年 ⇒ 2003年で22.2-25.2 ⇒ 92.2 /100 000と急速に増加
市中感染では, 7.6/100 000pt-yr, 5000件の抗生剤処方につき1件の発生 (JAMA 2009;301:954-62)
カナダでは, 新規入院患者の1.02%[0.97-1.06]でCD感染症が発症 (Arch Intern Med 2010;170:1804-10)
OutbreakにはNAP-1/027型が関与
Toxin A, B双方を産生し, キノロン耐性を示す
Quebec outbreakではFQ使用患者のRisk = セフェム使用患者のRisk (3.9[2.3-6.6] = 3.8[2.2-6.6])
第3の毒素; Binary toxinも産生することが分かっている(単独では病原性は乏しいが, Toxin A, Bと作用し, 重症化に関与)
C. difficileの6%がBinary toxinを産生
NAP1 strainは北米のCDADの28.4%を占め, 重症化, 死亡リスク因子となり得る
重症CDAD OR 1.74[1.36-2.22]
重症のアウトカム OR 1.66[1.09-2.54]
14日死亡 OR 2.12[1.22-3.68]
(Clinical Infectious Diseases 2014;58(10):1394–400)
CD-associated diarrhea
C. difficileが産生する毒素による大腸炎, 下痢症.
再入院、WBC上昇、長期間の入院(>=21d), 抗菌薬投与後6日以降の下痢はC. difficileを示唆
CDADのリスク:
抗菌薬開始後6日以降 OR 1.38
15日以上の入院 OR 1.33
便中WBC陽性 OR 2.39
Lactoferrin OR 3.74
水様便 OR 2.33
セファロスポリン暴露 OR 2.36 (J Clin Microbiology:2001;266-269)
C. difficile感染患者との接触も感染Riskとなる (特に若年, 抗生剤暴露ない群で)
腎不全もリスク因子の1つ (MayoClinProc.2012;87(11):1046-1053)
抗生剤投与によるCDADのリスク
抗菌薬投与ではCDADのOR 8.2[6.1-11.0] (CMAJ 2006;175:745)
抗生剤の種類別評価 (CMAJ 2008;179:767-72)
Antibiotics
|
RR
|
抗生剤全体
|
10.6[8.9-12.8]
|
テトラサイクリン
|
1.1[0.1-8.6]
|
ST合剤
|
1.2[0.4-3.3]
|
マクロライド
|
3.9[2.5-5.9]
|
レボフロキサシン
|
4.1[2.4-7.1]
|
ペニシリン
|
4.3[2.8-6.4]
|
シプロフロキサシン
|
5.0[3.7-6.9]
|
モキシフロキサシン
|
9.1[4.9-17.0]
|
セファロスポリン
|
14.9[10.9-20.3]
|
ガチフロキサシン
|
16.7[8.3-33.6]
|
クリンダマイシン
|
31.8[17.6-57.6]
|
その他
|
1.7[0.4-6.8]
|
また, 抗生剤使用後〜の日数とCDADのリスクは以下の通り
抗生剤使用後から急速にリスクは上昇し, 20日以内が最も多い.
その後減少するが2-3ヶ月はリスク上昇が持続する.
ドキシサイクリンはCDADのリスクを下げるかもしれない?
(Clinical Infectious Diseases 2012;55(5):615–20)
入院し, CTRXを投与された患者 2305名のフォロー.
2305名で2734入院症例.
DOXYを併用しているのが1066例, 併用(-)が1668例.
CTRX投与後30日以内のCDAD発症率は5.60/10000pt-d.
DOXY併用群ではCDAD発症率 1.67/10000pt-d,
非併用群では 8.11/10000pt-d.
性別, 年齢, 基礎疾患, 疾患など調節した多因子調節HRは 0.73[0.56-0.96]/1日投与 と, DOXYの併用はCDADのリスクを低下させ得る.
例えば, 市中肺炎の治療として,
CTRX + マクロライド 5日間投与 vs CTRX + DOXYでは,CDADのHR 0.15[0.03-0.77],
CTRX + FQ 5日間投与 vs CTRX + DOXYでは, CDADのHR 0.13[0.03-0.62]となる.
CAPで非定型肺炎カバーする際はDOXY併用の方が良いかもしれない.
CDADでは抗生剤暴露歴が必ずあるとは限らない
836名(>65yr)のcase-control study (CMAJ 2008;179:767-72)
(90日以内に入院歴のある患者は除く, 市中感染症)
45日以内の抗生剤暴露歴(-) 52.9%
90日以内の抗生剤暴露歴(-) 45.7%
約半数が抗生剤暴露が無い患者で発症している.
抗菌薬以外のRisk Factor (CMAJ 2006;175:745)(CMAJ 2008;179:767)
PPI投与OR 3.5[2.3-5.2] RR 1.6[1.3-2.0]
H2 blocker OR 1.4[0.8-2.5] RR 1.4[0.9-2.2]
年齢(5年毎) RR 1.4[1.3-1.5]
2年以内の入院歴 RR 2.2[2.0-2.4]
基礎疾患; IBD RR 4.1[2.6-6.6]
基礎疾患; IBS RR 3.4[2.3-5.0]
基礎疾患; 腎不全 RR1.7[1.3-2.2]
制酸剤とCDAD
前述のように制酸剤はCDADのリスクとなり得る.
ただしPPIのみであり, H2阻害薬はリスク因子とはならない.
重症例, 合併症併発例, 再発例, 治療失敗例 385例のCohort. (Mayo Clin Proc 2012;87(7):636-642)
23.4%がPPI, 13.5%がH2-blockerを使用.
制酸剤の使用とCDADアウトカムへの影響
再発や治療失敗, CDADの重症化に対しては制酸剤リスク因子とはならない.
ただしこの結果はPPIとH2阻害薬を分けて分析していない点に注意.
メトロニダゾール, バンコマイシンで治療されたCDAD 1166例のRetrospective cohortでは, (Arch Intern Med 2010;170:772-8)
その内, 45.2%が発症14d以内のPPI使用歴(+)であった.
再発性CDAD; CDAD発症後15-90日間の, CD toxin陽性と定義したとき,
PPIとCDAD再発の関連を評価.
Outcome;
15-90dの時点でCD toxinが陽性であったのは21.5%
Outcome
|
PPI(+)
|
PPI(-)
|
HR
|
@15-90d CD toxin陽性
|
25.2%
|
18.5%
|
1.42[1.10-1.83]
|
年齢別; <60yr
|
1.19[0.56-2.55]
|
||
60-80yr
|
1.32[0.94-1.85]
|
||
>80yr
|
1.86[1.15-3.01]
|
||
抗生剤暴露(+)群
|
1.71[1.11-2.64]
|
||
抗生剤暴露(-)群
|
1.30[0.94-1.79]
|
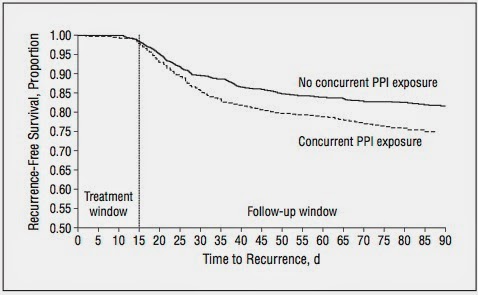
PPI使用は再発リスク因子となり得る.
また, PPI使用は長期間ほどCDAD発症の高リスクとなる.
(Mayo Clin Proc. 2013;88(10):1085-1090)
(入院患者でCDADを発症した67例とControl 137例の比較)
Colonization ≠ 感染
C. difficileが便中にいるのみでは感染ではなく, 毒素を産生して始めてCDADとなる.
4143名のProspective cohort study @ Canada (N Engl J Med 2011;365:1693-703.)
1回/wkの便検査施行し, 培養, Toxin A, Bを評価.
15Mのフォローにて, 117名(2.8%)でCD感染症(28.1/10000pt-d), 123名(3.0%)でColonization(29.5/10000pt-d)を確認.
感染症のリスクは高齢者, 抗生剤暴露, PPI暴露で上昇.
Colonizationは2m以内の入院, PPI, H2阻害薬暴露がリスクとなる
便培養陽性群のうち, CDAD発症リスクとなる因子
高齢者, PPI使用, 抗生剤使用, NAP1 strainがCDAD発症のリスクとなる.
下痢が無くてもC. difficile感染症かもしれない
入院中患者で, 原因不明のWBC>15000/µLを満たした60名. (Am J Med. 2003;115:543–546)
一般的な感染, ルート感染は除外されている状況.
CD toxinが陽性であったのは58% vs 12%(Control群: 入院中でWBC<15000群)
CD toxin(+)群の91%がAbx投与歴あり, 陰性群では72%(P=0.05)
CD toxin(+)の35名中, 腸炎症状を認めたのは30例(86%).
下痢が27例, イレウス4例. (イレウス→下痢が1例)
Toxin(-)群の25名中, 腸炎症状を認めたのは14例(56%). (P<0.05)
CD感染症ではWBCが高値となることがあり,
入院中の患者の発熱でWBCが高値の場合, 下痢は無くてもCD感染症は疑うべきと言える.
(CD感染におけるWBCについては②検査を参照)
C. difficileの腸管外感染症
極稀だが, C difficileの腸管外感染の報告がある.
31例の症例報告があり, CD感染全体の0.17%の頻度.
菌血症が2例, 手術治療が無い患者での腹腔内感染 4例, 手術治療後の腹腔内感染が7例, 肛門周囲膿瘍 4例, 創部感染症 13例, 尿カテーテルより検出されたのが1例.
85%が他の菌との混合感染で81%が院内感染. また併発症が多い患者が多かった.
(Clinical Infectious Diseases 2013;57(6):e148–53)