症例: アナフィラキシー発作を複数回繰り返す中年患者.
しかしながら食事や薬剤, 運動といった誘発因子は全く認められない.
症状は顔面の紅潮や浮腫, 小腸をはじめとした消化管の浮腫と消化管症状が主であり, ストレスが生じると出現する経過であるとのこと.
症状は数年前〜であり, それまではストレス下でも症状は認められなかった.
既往歴として骨髄線維症の指摘があるが, 血球減少はなく, 治療は不要と判断されている.
--------------------------
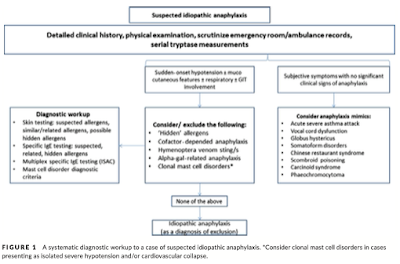
さて, どのような疾患が考えられるだろうか?
Anaphylaxisであるが, 明らかな誘因が不明な病態をIdiopathic anaphylaxisと呼ばれている.
(Clin Exp Allergy. 2019;49:942–952.)
・Anaphylaxisのうち6.5-59%は誘因が不明
・病歴聴取が不十分, 患者が認識していないといった理由や, アレルギー様の病態を呈する他疾患などが考えられる.
鑑別疾患は以下の通り;
*Globus: 咽喉頭神経症・客観的に評価された血管浮腫や症状があるかどうかでまず判断し,
あれば隠れたアレルゲンの精査や肥満細胞症を評価する.
主観的な症状のみの場合, 精神症や異常感覚などの評価を考慮する.
今症例では実際に顔面浮腫や紅潮, 消化管の浮腫などがあり, 客観的な症状は認められている.
アレルゲンの詳しい聴取は行うが, それでも見つからない場合, 繰り返す症状として肥満細胞症やSystemic capillary leak syndrome(SCLS)を考慮した.
背景の血液疾患が引っかかり, それが多発性骨髄腫やMGUSならばSCLSの可能性を考慮するが, 今症例ではそうではなく骨髄増殖性疾患である骨髄線維症であることから, 肥満細胞症の可能性があると判断.
さて肥満細胞症をまとめてみる.(SCLSも近いうちに書きます)
Systemic Mastocytosis
(Am J Hematol. 2021;96:508–525.)
・Mastocytosisは形態, 免疫表現型が異常な肥満細胞がクローナルに増殖し, 1つ以上の臓器に集積することで生じる疾患.
・皮膚に限局したCutaneous mastocytosis(CM) : 小児に多く(2歳以下での発症), 蕁麻疹を繰り返す.
典型的な所見は色素性蕁麻疹
(J Hematol Infect Dis 2021; 13; e2021068)・皮膚以外の多臓器に浸潤するSystemic mastocytosis(SM) : 成人例で多く, より重症.
消化管や心血管, 神経, 骨などが多い.
アナフィラキシーや全身性症状を呈することもある
リンパ節腫大や肝脾腫も肥満細胞の浸潤により生じる
非肥満細胞系の血液悪性腫瘍を生じるリスクにもなる
(HAWAI‘I JOURNAL OF MEDICINE & PUBLIC HEALTH, FEBRUARY 2018, VOL 77, NO 2, 27-29)
参考: 83例の消化管症状(+)のMastocytosisの解析
(J Allergy Clin Immunol 2013;132:866-73.)
・発症年齢は29歳[0-66], 女性例が7割を占める.
・非消化管症状としては, アナフィラキシーショック, 顔面紅潮 フラッシュ, 頻尿, 掻痒感等.
・c-Kit変異は高感度で認められる
・消化管症状は, 腹部膨隆, 腹痛, 嘔気嘔吐, 下痢, 血便.
MastocytosisはKITのPoint mutationを伴うことが多い.
・KITの3型受容体(CD117)は肥満細胞(MC), 造血前駆細胞, 生殖細胞, メラノサイト, 消化管のカジャール間質細胞で発現するチロシンキナーゼであり, 正常な肥満細胞の発生, 造血, 配偶子形成, メラニンの生成, 胃蠕動の制御に関連する.
・KITの発現は造血前駆細胞から成熟細胞への分化に伴い低下するが, 肥満細胞では高レベルで維持されている
・成人例のSMではKITのチロシンキナーゼドメインのGain-of-function somatic mutation, 特にD816V変異が大半で認められる. 他に認められるものは(<5%), V560G, D815K, D816Y, insVI815-816, D816F, D816H, D820Gが報告されている.
・小児例の肥満細胞症もクローン性であり, 生殖細胞や後天性のKIT変異が関連
・KIT D816Vが肥満細胞のみ生じる場合はIndolent SM(後述)のことが多く,
他の造血細胞にも生じるとより臓器障害も高度となる.
さらに他のSomatic mutaitonが合併すると重篤化する.
Systemic mastocytosisの診断: 2016年のWHO基準
・Major criteriaを満たし, Minorを1項目以上満たす場合,またはMinorを3項目以上満たす場合に診断となる
・診断は主に罹患臓器の組織検査, 骨髄検査, KIT 816のPoint mutation, 血清トリプターゼが重要
・さらにPhenotypeを判断するために臓器症状の評価を行う(B, C所見)
補足:
・国内では末梢血や骨髄検体にてKITシーケンス解析(AML)が検査可能だが, これはExon 8, 10, 11, 17を解析.
・KIT D816Vはexon 17に含まれるため, この検査で代用することは可能な可能性が高い.
・血清トリプターゼは自費検査となる
骨髄はSMにおいて最も浸潤を認める臓器の1つであり, 骨髄穿刺, 生検は診断に有用である.
・他の血液疾患の評価, 血液腫瘍の評価目的としても有用である.
・診断上重要な多巣性高密度のMC凝集はギムザ染色などの標準染色法では認識できないことがある. 特に低顆粒化や異常核形態, AML合併, 細網繊維が存在する場合は所見が認められないことが多い. 免疫組織マーカーとしてトリプターゼを用いると診断能は良好. ただし, CMLやAMLの一部の芽球や好塩基球では陽性となり得る.
・CD25発現細胞の検出はMC評価に有用.
腫瘍性のMCは一般的にCD25 and/or CD2を発現している
・正常のMCではCD25陰性であり, その点で異常MCと正常MCの鑑別が可能
・骨髄液を用いたフローサイトにてCD117 highでゲートし, その細胞集塊でCD25, CD2を評価する. CD117high, CD45intでゲートしてもよい.
SMの骨髄では細網線維の増生, 肥満細胞の浸潤, 他好酸球浸潤やリンパ球の浸潤が認められる.
・Type 1; 局所的, 斑状のSMの浸潤とその周囲の細網線維の増生や,
Type 2; シート状の浸潤+骨硬化, 骨髄線維化など認められる.
Type 3; CMLやCMML, AMLの所見を合併する例もある.
・骨髄だけではなく, 脾臓や肝臓, 類洞周囲にも線維性変化を認め, 線維化を促すサイトカインの関連が示唆されている.
・骨髄線維症や本態性血小板増多症患者の骨髄では, 他のMPNと比較して骨髄中肥満細胞量が多いことも示されている.
(Int Arch Allergy Immunol 2002;127:123–126)(Pathology – Research and Practice 205 (2009) 634–638)
血清トリプターゼ
・肥満細胞症では血清トリプターゼの持続的な上昇(≥20ng/mL)が認められる
・特に血液腫瘍合併例ではISMと比較してより高値となりやすい(≥200ng/mL)
・AMLやCMLの一部でも上昇する.
SMと可溶性IL-2R
・SMで認められるCD25はIL-2R alpha chainであり, 可溶性IL-2Rの上昇が認められる可能性がある.
・健常人では955pg/mL[138-2829] SM患者全体では2491pg/mL[310-15020]
Anaphylaxis群では1361であり, SMではIL-2Rは上昇する.
・SMでも進行性ほどIL-2Rも高い (Ia: 皮膚SM, Ib: Indolent SM, II: 血液疾患由来SM, III: agrSM)
(Blood. 2000;96: 1267-1273)
SMの分類: 2016年WHO分類
Indolent SM: SMの46%を占める最も多いパターン
・C所見を認めないSM(骨髄不全, 障害をともなう肝脾腫, 骨浸潤, 低栄養, 吸収不良など)
・他の活動性SMと比較してより若年(中央値49歳)であり, 皮膚病変やMCMRS*, 消化管症状の頻度が高い(66-75%)
*MCMRS: MC mediator-release symptoms. アナフィラキシーなど
・肝脾腫や消耗症状の頻度は低い(<20%)
・ISMは一般人口と比較して生命予後は同等
・急性白血病やASMへの移行リスクは低い(<1%, 3%)
Smoldering SM: ISMのうち, 2つ以上のB所見を有する群
・B所見: 骨髄MC浸潤が>30%, 骨髄異形性/増殖症, 肝脾腫(肝障害や脾機能亢進を伴わない)
・ISMのうち14%がSMM, 骨髄浸潤のみ認めるBMMが23%.
・ISMよりも予後が不良(HR 5.5[2.8-10.2])
・BMMではよりアナフィラキシーなどのMCMRSの頻度が高い(86%).
SM-AHN: SM-associated hematological neoplasm. SMの40%
・主に骨髄腫瘍が多く(89%), 次いでリンパ腫, 骨髄腫, CLL, Primary amyloidosisが数例.
・骨髄腫瘍では, SM-MPNが45%, SM-CMMLが29%, SM-MDSが23%
34%で好酸球増多(≥1500/µL)を認める. 特にSM-MPNでは56%と多く, このうち39%でFIP1L1-PDGFRA融合遺伝子が認められた.
・高齢者のSM(≥70歳発症)では, 32/42例がSM-AHN
CMMLが7例, AMLが1例, MDSが7例, 骨髄線維症が1例, MPDが1例 MMが1例, B細胞リンパ腫が1例, 血小板減少が4例. (Am. J. Hematol. 88:406–408, 2013.)
Aggressive SM: SMの12%であり, 3番目に多いタイプ
・C所見を1項目以上認めるSM
・消耗症状(60%), 肝脾腫(50%), リンパ節腫大(30%)を認め, さらに重度の貧血や血小板減少を認める(24-27%) . 白血球増多が41%
・血清トリプターゼは著明に上昇を認める(>200ng/mL, 40%)
・白血病転化が5%で認められ, 全体の中央生存期間は41ヶ月間
Mast cell leukemia(MCL): 稀であり, SMの1%程度
・SMの基準を満たし, 骨髄生検にてびまん性の異常MCの浸潤を認める.
骨髄穿刺スメアではMC≥20%を認める. 古典的には末梢血中のMC≥10%
・予後不良の病態であり, 中央生存期間は2ヶ月.
ECNM登録データでは, 中央OSは1.9年間, 10年生存率は29.9%
MCLは急性と慢性を区別する
(Leukemia Research 39 (2015) 1–5)
・MCLはSMの稀な病態で, 未熟な肥満細胞の白血病的拡大, 臓器障害, 薬剤耐性を呈し, 予後不良な病態である.
・MCLの一般的な生命予後は1年未満であるが, 稀に緩徐に進行し, 臓器障害を呈さず, 肥満細胞もより成熟した形態で存在するタイプもある.
・これらを分類するために, 前者を急性MCL, 後者を慢性MCLとして区別される
・慢性MCLは骨髄中肥満細胞が≥20%を満たし, 且つC症状を認めないことで定義される.
・慢性MCLでは, MCは成熟MCや紡錘形のMCとなることが多い(A, B)
・急性MCLでは, 未熟なMCが主であり, Metachromaticな顆粒状の芽球が認められるが, これは慢性MCLでは認められない
・二重, 多葉核は双方で認められる.
慢性MCLの臨床経過
・慢性MCLの経過は緩徐であり, SSMの経過と類似する.
・数カ月〜数年の緩やかな経過を呈する患者もいれば, 短期間でAMLに移行する患者もいる. 多くの症例が最終的に急性MCLへ移行する.
・C所見が認められた時点で慢性MCLは急性MCLとして扱う.
Mayo Clinicで1976-2007年に診断されたSM 342例の症状頻度: (Blood. 2009;113:5727-5736)
SMの治療
・Indolent/Smouldering SMでは対症療法が基本.
それ以上ではKIT阻害薬やImatinib, Cladribineなどを考慮する
・MCLの治療:
MCLでは, 大半の患者でKIT D816Vに対するTKIなどの標的薬に耐性がある
急性MCLで若年で健康ならば多剤併用化学療法+SCTが推奨される. 高齢者ではクラドリビンなどの化学療法, TKIが検討される.
慢性MCLではTKI単独, または化学療法との併用が選択肢となることがある. これはKIT D816Vが認められた場合にTKIの効果が期待できるため, 評価することが重要.
他のKIT変異にはイマチニブが選択肢となることがある.
・緩和治療としてはヒドロキシウレアやプレドニゾロンが試される
・ISM, SSMにおける 対症療法の推奨
・Aggressive SMの治療はKIT阻害薬が効果的である.(国内は未承認)
KIT阻害薬にはMidostaurinやAvapritinibがある.
MidostaurinはKIT D816Vを含む複数のKinaseを阻害する経口薬 Aggressive SMに対して効果的との報告がある.
(N Engl J Med 2016;374:2530-41.)
・成人のAggressive SM, SM-AHN, MCL症例を対象とし, Open-labelでMidostaurinを100mg bidを4wk継続. 副作用が認められた場合は50mg bidに減量, または中止.
・アウトカム: ORRは60%[49-70] Major response 45%
骨髄MC量と血清トリプターゼの 変化値はそれぞれ-59%, -58%
多い有害事象は嘔気, 嘔吐, 下痢 また血球減少も2-4割で認める.
Avapritinibは選択型1型KIT阻害薬であり, KIT D816Vに強く作用する. FDAでは2021年にAdvSM, SM-AHN, MCLに対して承認された.
(Nat Med. 2021 Dec;27(12):2183-2191)
・Phase 1 study; AdvSM患者 86例に対して, Avapritinib 30-400mg/dを投与し, 最大耐用量を評価. 実際は最大耐用量は200-300mgであった.
・副作用は眼瞼周囲浮腫が69%, 貧血 55%, 下痢 45%, 血小板減少 44%, 嘔気 44%が高頻度で認められた.
・ORは75%, さらにCRは36%で認められ, ほぼCRが得られなかったMidostaurinよりもAdvSMに対する有用性が期待されている.
・第2層試験は200mg/dで行われる
他のTKI
・イマチニブはKIT D816V陰性例(exon 17以外の症例)で効果が見込める.
特にexon 8-11の変異例やFIP1L1/PDGFRαを認める症例で良い適応
(Front. Pharmacol. 11:443. doi: 10.3389/fphar.2020.00443)
・ニンテダニブ(オフェブ®): マルチキナーゼ阻害薬.
進行性SM, 肥満細胞白血病患者より抽出したKIT D816VのiPS細胞パネルを用いて, 疾患もモデルを作成し, KIT D816Vを標的とするチロシンキナーゼ阻害薬を検討したところ, NintedanibがKIT D816V阻害作用を認めることが判明.
Nintedanibは新たなSM治療薬となりえる. (Blood. 2021;137(15):2070-2084)
TKI以外の化学療法: Cladribin ロイスタチン®
・Cladribine 0.10-0.13mg/kgを2hで投与. Day 1-5で投与し, 4-8wk毎に最大6サイクル繰り返す.
(Blood. 2003;102:4270-4276)
SMに対して, 2-CdA治療を行なった患者68例の解析
(Blood. 2015;126(8):1009-1016)
・2-CdA: Cladribine 0.14mg/kg IV or SCをDay 1-5, 4-12wk開けて繰り返す. 1-9サイクル施行.
・患者はISMが53%, ASMが47% 中央サイクル数は3.7サイクル[1-9],
ORRは72%(CR 0, Major response 47%, Partial 25%)
CR: 全ての症状, 所見が1ヶ月以上改善している状態.
MR: >50%改善を認める状態
PR: 10-50%改善を認める状態で定義.
・症状の変化
倦怠感や皮膚症状, 消化管症状は有意に改善
アナフィラキシーや神経精神症状も改善する.
色素性蕁麻疹, 臓器腫大も有意に減少
・副作用の頻度
大半の患者において治療耐用性は良好.
Grade 3-4の副作用は骨髄抑制と感染症.
骨髄抑制では, 急性好中球減少: Grade 3 13%, Grade 4 34%
遷延性リンパ球減少: 82%
ISMの1例で汎血球減少あり
・感染では菌血症やカンジダ血症, 日和見感染症などが報告.
Mayo Clinic SM databaseより, Cladribineで治療されたSM 42例を解析 (adv-SMが22例, ISMが17例, SSMが3例)
(British Journal of Haematology, 2022, 196, 975–983)
・adv-SM 22例のおける解析:
adv-SMでは, CRは0%, PRが32%, Pure clinical response 14%
副作用は血球減少が主.
・ISM, SSM20例の解析:
CRが20%, MR 40%, PR 10%. 7割で反応が認められる
造血幹細胞移植
(Biol Blood Marrow Transplant 22 (2016) 1348-1356)
・SMにおける造血幹細胞移植の報告は, 主にSM-AHN(血液腫瘍を合併したSM)でAHNの適応により行われる報告が主
・急性MCL(肥満細胞性白血病)ではAlloHCTは推奨される.
慢性MCLでは病状に応じて判断が必要
・血液腫瘍を合併していないSMでは, 進行性SMで移植を考慮する.
一方でIndolentやSmolderingでは余命は悪くないため, これらの鑑別は重要.
・移植関連死亡もあるため, 進行性SMではまずTKIやクラドリビンを優先する.
SMの予後因子
・European Competence Network on Mastocytosisにおいて, 1639例を後ろ向きに評価し, 予後因子を抽出 (Lancet Haematol. 2019 Dec;6(12):e638-e649.)
・非AdvSM例では, 高齢者, ALPがリスク因子となる