PFOについてはこちらも参照
特に専門は絞っていない内科医のブログ *医学情報のブログです. 個別の相談には応じられません. 現在コメントの返事がうまくかけませんのでコメントを閉じています. コメントがあればFBページでお願いします
ページ
2021年12月23日木曜日
PFOにおける塞栓症リスクと閉鎖療法のベネフィット
2021年12月20日月曜日
抗セントロメア抗体の値と強皮症の進行リスク
抗セントロメア抗体は限局型全身性強皮症の抗体として有名.
他にも原発性胆汁性胆管炎などでも陽性となる.
抗セントロメア抗体の抗体価と予後への影響を評価した報告
(Arthritis & Rheumatology Vol. 73, No. 12, December 2021, pp 2338–2347)
・5つのCohortより, IgG ACA陽性でVery early SScを満たす, またはSScのACR/EULAR013基準を満たす患者を評価.
・Very early SScは, IgG ACA陽性で以下の1つ以上を満たし, さらにACR/EULAR2013のSSc基準を満たさない患者で定義;
Raynaud現象, Puffy fingers, NFC異常
・BaselineのIgG ACAの値と, その後のSScへの進展リスク, 臓器障害リスクを評価した.
・臓器障害はDigital ulcer, ILD, 心筋障害(不整脈や伝導障害, EFの低下, 心外膜炎など), 肺高血圧, 消化管障害を含む
・ACAの評価はFEIA(酵素免疫測定法)を用いて測定
IgG ACAのカットオフは 7 U/mL(製品より)
IgMとIgAも測定. 健常人サンプルよりカットオフはIgA ACA 37AU/mL, IgM ACAは13AU/mLとした.
アウトカム
・IgG ACA陽性例 625例のうち,
Very early SScが138例, 臓器障害(-)のSScが240例, 臓器障害(+)のSScが247例
・IgG ACAはVery early SScで274[93-662] U/mL臓器障害(-)SScで480[197-990]
臓器障害(+)SScで619[263-1077] とSSc症例や臓器障害(+)例で高くなる傾向がある
・Very early SScとSScを比較すると, 有意にACA値がSScで高値.
・さらに, Very early SScにおいて, IgG ACA値が高いと, SScへ進行するリスクも高くなる.
Very early SSc 115例のうち, 5年間のフォローにてSScへ進行する例は48例(42%)認められた.
母集団におけるACA値の分布
Very early SScにおける, ACA値とその後のSSc進行例と非進行例
2021年12月16日木曜日
ワクチン投与時のDMARDs 薬剤調節
メモがてら:
Impact of disease-modifying antirheumatic drugs on vaccine immunogenicity in patients with inflammatory rheumatic and musculoskeletal diseases
Ann Rheum Dis 2021;80:1255–1265.
DMARDsのワクチンへの影響は以下の通り:
・MTX, ABA, RTXはワクチンへの影響が顕著.
これを踏まえた, 各種ワクチン接種時の投薬調節推奨
ワクチン | ワクチンの推奨 | DMARDの調節 |
インフルエンザ | 全患者に毎年4価ワクチンを推奨 | RTX: RTX開始前に投与. 最終投与から6ヶ月以上開けて, 次回投与の4wk以上前に投与する |
肺炎球菌 | 免疫抑制状態の患者全例で推奨 | RTX: RTX開始前に投与. 最終投与から6ヶ月以上開けて, 次回投与の4wk以上前に投与する |
帯状疱疹 | 50歳以上で推奨 | RTX: RTX開始前に投与. 最終投与から6ヶ月以上開けて, 次回投与の4wk以上前に投与する |
HBV | HBV感染リスクがある人で推奨 | RTX: RTX開始前に投与. 最終投与から6ヶ月以上開けて, 次回投与の4wk以上前に投与する |
HPV | 一般的なガイドラインに準拠(各国) | RTX: RTX開始前に投与. 最終投与から6ヶ月以上開けて, 次回投与の4wk以上前に投与する |
破傷風 | 一般的なガイドラインに準拠(各国) | RTX: RTX開始前に投与. |
Yellow Fever | 免疫抑制患者では避ける | 禁忌 |
ワクチン | ワクチンの推奨 | DMARDの調節 |
SARS-CoV-2 | 全ての人で推奨される | RTX: 最終投与からなるべく空けて投与. 次回投与から2-4wk前に投与する. MTX: mRNAワクチン後1週間休薬. 単回投与ワクチンでは2週間休薬する. MMF, JAK阻害薬: ワクチン後1週間休薬 以下は投与調節不要 |
2021年12月8日水曜日
黄色ブドウ球菌菌血症におけるPET/CT
黄色ブドウ球菌菌血症(SAB)におけるPET/CTの意義を評価したProspectiveのCase-control study.
(Clinical Infectious Diseases® 2021;73(11):e3859–66)
私個人としては, SABにおいて, 感染のFocusがどこなのか, それが臨床判断とどの程度解離しているのかが気になり, 読んでみることにした.
成人のSAB症例を対象とした前向きCohort.
・SAB診断の7-14日後にFDG-PET/CTを評価した症例(2015-2019年)をIntervention groupとし,
FDG-PET/CTが行われなかったSAB症例(2015-2018年)をControl groupとした.
・PET/CT検査を施行するかどうかはは臨床医の判断により行われた.
・Control groupは, 以下の条件をMatchさせている;
1) SAB診断〜Intervention群におけるFGD-PET/CT撮影までの期間, 生存していた患者
2) MSSA, MRSAによる菌血症
3) インフォームドコンセントが得られている
4) Charlson’s comorbidityスコア(±3まで許容されるが, best matchを選択)
5) 年齢(±10歳までは許容されるが, best matchを選択)
第7病日まで生存していたSAB症例が531例.
・このうちPET/CTが施行されたのが149例(151エピソード)
Control群として150例(151エピソード)を選択し, PET/CTによる予後への影響を評価.
両群の母集団
PET/CTによる診断への影響
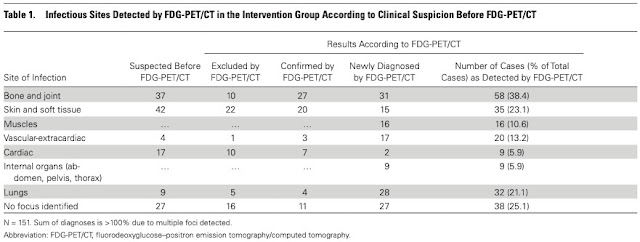
・感染のFocusで最も多かった部位が骨関節.
臨床上疑われたのが37例, PET/CTで否定されたのが10例, 新たに診断されたのが31例
・多くが臨床判断とPET/CTの集積に解離がある.
90日死亡に関連する因子.
・年齢や合併症, 院内感染 治療開始後3日を超えての発熱や菌血症は 有意に死亡リスクを上昇させる因子
・PET/CTの施行は死亡リスクの低下に関連
--------------------------
SABにおいて, 臨床判断の感染Focusのおよそ1/3~1/2, または半分以上がPET/CTで評価すると他のFocusであった.
皮膚軟部組織, 心内膜炎は高く見積もりがち: IEは心配だし, SAは軟部組織からが多いしそれはしかたない.
一方で, 肺や骨関節, 筋, 血管(心臓以外)は低く見積がちな傾向がある.
2021年12月7日火曜日
帯状疱疹ワクチンによるギランバレー症候群のリスク
(JAMA Intern Med. 2021;181(12):1623-1630. doi:10.1001/jamainternmed.2021.6227)
VZVワクチンによるGBSリスク
・65歳以上でRecombinant VZVワクチン(RZV, シングリックス)を接種した849397例と 65歳以上で生ワクチン(Zostavax, ZVL)を接種した1817099例において, ワクチン接種後(1-42日)におけるGBS発症リスクを評価した報告
・6ヶ月以内にGBSの診断が既にされている患者や, RZVを添付文章外使用した患者(3回以上投与した患者, 1回目投与から42日以内に2回目を投与した患者)は除外.
・RZVにおけるGBSリスクを評価するために,
ZVL投与後1-42日で発症したGBSをControlとして評価.
また, Self-controlとして, Control periodとしてワクチン接種後 43日~183日を設定(1回目, 2回目ともに). その間に発症したGBSをControlとしてRZV投与後1-42日におけるGBS発症率を比較した.
両群の母集団
アウトカム
・GBS発症症例
RZVとZVLにおける比較
・GBSはRZVで15例(100万件で0.29例), ZVLで9例(100万件で0.12例)
RZVはZVLと比較して有意にGBSリスクが高い(RR 2.34[1.01-5.41])
RZVのSelf-controlにおける評価
・Self-controlでは, RR 4.30[1.76-10.53]
100万件のワクチン接種あたり, 6.47[2.50-10.45]例のGBSが増加
Discussionより
・VZV再活性化後のGBSリスクはRR 4.0[1.9-8.7]
100万回の感染エピソードあたり12.8例[3.7-31.9]と推測される
・このデータとワクチンの効果(97%)を考慮すると, 100万人の完全接種者あたり6.26件のGBSが発症する.
・RZVのリスクベネフィットを調査したモデルによると,
60-69歳におけるRZVワクチン接種において,
過剰なGBSは6.3例,
予防できたVZV再活性化は61600例
(このうち死亡の可能性62例, 眼合併症5500例, 帯状疱疹後神経痛が9350例) とRZVのVZV再活性化予防効果はGBSリスクを上回るベネフィットと捉えられる.
膠原病に伴う血球貪食症候群の背景疾患
膠原病に伴うHLHの背景疾患を文献Reviewにて調査した報告
(Eur Rev Med Pharmacol Sci. 2012 Oct;16(10):1414-24.)
・117論文, 421例
疾患 | 頻度 |
SLE | 94例 |
AOSD | 37例 |
RA | 13例 |
JRA | 219例 |
DM | 7例 |
川崎病 | 25例 |
SSc | 5例 |
ベーチェット病 | 1例 |
PAN | 6例 |
AS | 2例 |
MCTD | 1例 |
サルコイドーシス | 5例 |
pSS | 3例 |
GPA | 1例 |
分類不能 | 2例 |
・背景疾患として多く報告されているのはJRA(小児リウマチ), SLE, AOSD, 川崎病.
・活動性感染症の合併も含まれる : CMV(4例), EBV(4例), HSV-1, パルボB19, 粟粒結核, Histoplasmosis, leishmaniasis
SLEの5/94, RAの1/13, AOSDの2/37で感染の併発があった.
・免疫抑制療法がTriggerとなった 症例も20例あり.
原因薬剤はADA, IFX, ETN, レフルノミド, サルファサラジン, AZA, MTX
・他に非ホジキンリンパ腫や抗マラリア薬が誘因となった症例もあり
SLEにおけるHLH発症の誘因として, 多いものはフレアと感染症の合併.
(Cureus 13(10): e18822. DOI 10.7759/cureus.18822)
・感染症ではEBVが最も多い誘発因子であり, ついでCMVが多い.
・細菌感染症も誘因となり得る
・ヒドロキシクロロキンはHLHリスクを低下させる
SLEとAOSDに伴うHLHを比較した報告では,
(ARTHRITIS & RHEUMATOLOGY Vol. 66, No. 8, August 2014, pp 2297–2307)
・SLEを背景とする場合はよりWBCが低値, CPRが低い.・AOSDではWBC減少は生じにくく, フェリチンが数万と著明に高値となる
--------------------------
あまりデータがない分野
2021年12月1日水曜日
リツキシマブ使用患者におけるPCPの予防
PCPはCD4+ cellの活性低下がリスクとなるが, 動物実験ではB cellも免疫に関与している結果がでている.
・Mayo clinicにおいて, 1998-2011年に リツキシマブ使用中に発症したPCP症例は30例.
ステロイド併用が73%で, 10%はリツキシマブ単独投与下でのPCP発症であった.
PCPの予防投与をされていたのは1例のみで, 大半が予防投与無し.
53%がICU管理となり, 死亡率は30%であった.
(Chest 2013;144:258-265)
リツキシマブ使用中の患者でのPCPの予防推奨は未だはっきりしていないのが現状.
そんななか, 韓国より後ろ向き解析が発表.
(Chest 10.1016/j.chest.2021.11.007)
RTX使用患におけるPCP予防の効果を調査した韓国からの報告
・韓国のSeoul National Univ. Hosp. において, 2002-2018年にRTXが使用された患者群 3524例を解析.
・このうち血液疾患が2500例, リウマチ性疾患が559例, 臓器移植が465例.
・ST合剤によるPCP予防が行われたのが1001例であった (RTX投与開始から28日以内に開始された群をITT解析で採用. 28日を超えて開始された例が254例あり. )
・アウトカムは予防の有無と1年間におけるPCP発症リスク.
・PCPの診断は検体からの病原菌の検出(染色やPCR)があった症例で, さらにエキスパート2名がカルテをReviewし, 経過や画像より妥当性を検討.
母集団
a) PN, ASP, クリオグロブリン血管炎を含むb) ITP, TTP, IVL, WMを含む
c) GFR<60mL/min, d) Ly<800/µL, e) PSL≥30mg/d
・膠原病ではAAVとRAが多い 他はSLE, 炎症性筋疾患
・AAVでは予防されている例が多いが, RAでは少ない
・ST合剤の投与期間は 平均153.8±107.6日間
アウトカム
・2759.9pt-yのフォロー期間でPCPは92例で発症.
(リウマチ性疾患10例, 血液疾患74例, 移植18例)
・疾患群別の発症率(/100pt-y, Control群)は,
全体で4.11[3.26-5.12]
リウマチ性疾患で2.96[1.19-6.09],
血液疾患 4.50[3.44-5.78],
臓器移植 7.01[3.63-12.25]
・RTX開始〜PCP発症までの中央期間は86±80日間
・ PCP関連死亡率は27.2%
・PCPの発症リスクに大きく関与する因子は,
腎機能低下(GFR<60) aSHR 2.38[1.75-3.23]
高用量ステロイド(PSL≥30/d) aSHR 3.09[2.22-4.30] であった.
ST合剤による予防効果
・PCPの頻度は Control群で4.13, 予防群で1.47/100pt-yと 有意に予防群で低下
・高用量GC使用例を除外した群では aSHR 0.14[0.04-0.52]
IPTWを適応しない場合 aSHR 0.26[0.14-0.47]
1:1のPropensity score matchedでの比較 aSHR 0.35[0.16-0.79]
・他の免疫抑制療法/抗癌剤を使用していない群でも同様の予防効果
・予防によるNNTは32[24.8-39.4]
副作用によるNNHは101[61.9-261.1]
・また, 予防効果は140日以上継続した症例でさらに高い.
疾患群別の評価では
・リウマチ性疾患, 血液疾患, 移植患者群すべてST投与による PCP予防効果は良好に得られる.
・リウマチ性疾患患者では, 死亡リスクの低下効果もあり.
・疾患群別のNNTは,
リウマチ性疾患 23[16.6-36.4]
血液疾患 36[27.7-46.6],
移植患者では27[13.6-101.1]
・高用量GC併用群では17[12.1-25.7]とさらにNNTは良好となる
---------------------------
RTX使用患者でもST合剤によるPCP予防は考慮する価値がありそう
国内ではAAVが主なので, 大体併用していますが
2021年11月29日月曜日
RA患者における好中球減少症: Felty症候群と大型顆粒リンパ球増多症(LGL lymphocytosis)
関節リウマチ患者で好中球減少を生じた場合, 第一に薬剤性(MTXや他のcsDMARD, トシリツマブが代表的)を疑う.
薬剤性の可能性が否定的であり, 他に原因も乏しい場合, Felty症候群やT-LGL leukemiaを考慮する.
(Joint Bone Spine. 2015 Jul;82(4):235-9.)
Felty症候群はRA, 脾腫, 好中球減少の3徴を特徴する疾患
(Acta Haematol 2021;144:403–412)(Best Practice & Research Clinical Rheumatology Vol. 18, No. 5, pp. 631–645, 2004)
・RA患者の<1-3%で認められる.
診断から10年以上経過したRAで認められることが多い.
・Felty症候群を伴うRAでは, 関節外症状を伴う頻度が高い:
91%が脾腫以外の関節外症状を伴う.
リウマチ結節 76%, 体重減少 68%, 続発性Sjogren症候群 56%, リンパ節腫大 34%, 下肢潰瘍 25%, 胸膜炎 19%, 皮膚色素沈着 17%, 神経障害 17%, 上強膜炎 8%, 溶血性貧血など
・関節炎の活動性とは必ずしも一致しておらず, 100例のFSのうち35例は治療が不要な状態であった報告もある. 一方で, 骨破壊は高度な症例が多い.
・リウマチ因子の陽性率は95-100%であり, 高力価となる(中央値 10240[範囲640-81920]). (Medicine (Baltimore). 1986 Mar;65(2):107-12.)
ANAは47-100%で陽性. 抗ヒストン抗体も68-83%で陽性となる.
報告では, 非特異的なANCAが8割で陽性となるものもある.
免疫グロブリンは上昇し, 補体は低値となることが多い
・また, HLA-DR4との強い関連が示されている
・好中球減少の機序はSLEと同じく, 免疫機序による, 骨髄の顆粒球分化の抑制, G-CSFによる成熟化の抑制, 末梢血での血球破壊が生じている
・骨髄像では骨髄球系の過形成, Maturation arrestが多く認められる
また頻度は少ないが, 正常骨髄や低形成骨髄となることもある.
特異的な所見は認めないため, 基本的に骨髄検査は他疾患の除外目的で行う.
このFelty症候群と類似した病態となり, しばしばRAでの合併も多い疾患がLGL lymphocytosis(大型顆粒リンパ球増多症) [特にそのうちのT-LGLL(T細胞性大型顆粒リンパ球性白血病)]である.
・LGL lymphocytosisは慢性リンパ増殖性疾患の5-6%を占める(アジア)
Large granular lymphocyte: LGLとは
・LGL: 大型顆粒リンパ球.
末梢血単核球のSubsetの一つであり, 正常の末梢血にもある(<250/µL, 5-10%程度)
・直径12-20µmの細胞で, 淡青色の細胞質, 偏心した核, 顕著なアズール親和性顆粒を有する.
・酸性ホスファターゼに染まり, MPOで染まらないため, リンパ球系がオリジンと考えられる.
・CD3-NK細胞, またはCD3+活性型細胞傷害T細胞の双方に由来するLGLがある;
CD3+LGL(T-LGL), CD3-LGL(NK-LGL)
A) リンパ球,
B,C) LGL
(Hematology Am Soc Hematol Educ Program. 2017 Dec 8;2017(1):181-186.)
LGL lymphocytosis: LGL増多症
・LGLは通常<300/µL程度であるが, 6ヶ月を超えて>2000/µLとなる場合や,
Clonalな増殖(>500/µL)が認められる場合はLGL増多症(LGL lymphocytosis), LGL白血病(LGL leukemia)と呼ぶ(LGLL).
・LGL増多症では, 好中球減少, 貧血, しばしばPLT低下を認め, 脾腫を伴う.
末梢血, 骨髄リンパ球増多を認める点が特徴. (末梢血Ly >4500/µL, 骨髄リンパ球分画>23.8%)
・ClonalなLGL増殖はT-LGLで多く, TCR rearrangementで検出が可能.
非クローン性のLGL増殖は反応性に生じ, CMVやHTLV-1, HIV, EBVなどの慢性感染症に伴うものが知られている. また, 脾摘後や骨髄移植後に認められるものもある.
・WHOの分類ではLGLは成熟T細胞/NK細胞性腫瘍に含まれる.
T細胞の要素を持つLGLではT cell LGL leukemia (T-LGLL)
NK細胞の要素を持つLGLではChronic lymphoproliferative disorder of NK cell (CLPD-NK)と呼ばれる.
稀であるが, 予後不良のAggressive NK-cell leukemiaもLGLが増殖するためにこの分類に含まれる. 主にアジア人で報告され, EBV感染症の関連がある.
頻度はT cell LGL leukemiaが85%と最も多い (Blood. 2017;129(9):1082-1094)
LGLLの主な症状は消耗症状
・LGLLの中央年齢は60歳であり, <50歳での発症は<25%のみと少ない. 小児例はまれ.
・1/3は診断時に無症候
・初発症状/所見で多いのは好中球減少(70-80%)と, 再発性の口腔内アフタ.
好中球減少による感染症は15%程度.
アジア人では好中球減少の頻度は低いが, 赤芽球瘻の頻度が高い.
・他に脾腫, 神経障害(特に多発単神経炎), リンパ節腫大, Polyendocrinopathy, 口腔内潰瘍が認められることがある.
脾腫は20-50%, リンパ節腫大は希
・リンパ球数は4000-10000/µL, LGL数は1-6000/µL LGL<500/µLが7-36%で認められるため, 少なくても除外はできない
・好中球減少は重症(<500/µL)が16-48%, 中等度(<1500)が48-80%
貧血は多く, 輸血依存が10-30%,
PRCAは8-19%で合併
血小板減少は中等度のことが多く, 頻度は<25%
・LGLLではCD4+:CD8+比の逆転, CD8+CD57+の共発現, 活性型T細胞(CD3+/DR+)の出現などリンパ球の異常が認められる.
最も多い細胞のPhenotypeはCD2+, CD3+, CD4-, CD8+, CD16+, CD57+
(Best Practice & Research Clinical Rheumatology Vol. 18, No. 5, pp. 631–645, 2004)(Blood. 2017;129(9):1082-1094)
T-LGLLの背景疾患
・自己免疫疾患に合併する例が多く, 特に関節リウマチを背景とすることが多い
・他には自己免疫性血球減少や他の血液腫瘍, MDSの合併がある
(Blood. 2017;129(9):1082-1094)T-LGLLとRAやFelty症候群とのOverlap
・T-LGLL患者の20%程度(11-36%)がRAを合併している
一般人口におけるRA有病率は0.5-1%
また, RA患者でLGLのクローナルな増加が認められるのが3.6%
・FS患者では報告によりバラつきはあるが30-40%でLGLの増加が認められる.
またClonalな増殖が認められる症例も多い(TCR rearrangement)
・アジア人のLGL leukemia患者では, 西欧人と比べてRAを発症するリスクが少ない(1/7)
・Felty症候群はRA患者における好中球減少, 脾腫を伴う病態であり, 臨床的にはLGLLと類似する.
また, RAに合併するT-LGLLの90%でHLA-DR4が検出され(非RA合併例では33%であり, 一般人口と同等), RA合併T-LGLLとFSは同様の病態スペクトラムと捉えらえる考えもある
(Curr Opin Hematol. 2011 July ; 18(4): 254–259.)(Best Practice & Research Clinical Rheumatology Vol. 18, No. 5, pp. 631–645, 2004)
・基本的にRA患者の原因が不明確な好中球減少において, RAに合併するT-LGLLとFSはT細胞のクローナルな増生があるかどうかで鑑別する.
RA患者の他に原因が認められない好中球減少において, TCR遺伝子rearrangementが認められればT-LGLL, 認められない場合はFS
・最近報告ではさらに, STAT3 geneがT-LGLLの27-72%, STAT5b geneが2%で認められる報告があり, 両者の鑑別に有用な可能性が示唆されている.
(Rheumatology International (2021) 41:147–156)
単一施設のRA患者を後ろ向きに解析
(Rheumatology International (2021) 41:147–156)
・ACR/EULAR 2010基準でRAと判断されて, さらに末梢血好中球減少 and/or LGL上昇(>2000/µL)を満たす81例を解析.
・TCR遺伝子rearrangementの結果でT-LGLLとFSを分類し, 両群を比較した
アウトカム
・FSが25例, T-LGLLが56例
年齢やRA罹患期間は両者で差はない.
Erosive arthritis, RF陽性, ACPA陽性の頻度も同等.
脾腫はFSで83%, T-LGLLで56%とややFSで多い
白血球低下の程度はFSの方が顕著であり, リンパ球はT-LGLLで多い.
LGLの絶対数もT-LGLLで多い
STAT3変異陽性はFSで0%, T-LGLLで39%とFSでSTAT3変異は認めない
LGL増多症の診療アルゴリズム
・リンパ球の増多やRAを伴う好中球減少, 貧血, 繰り返す感染症で疑う.
・末梢血スメアを確認し, LGLの増加の有無を評価.
増加があればClonalな増生かどうかをフローサイトやTCRγ rearrangementで評価
・Polyclonalならば反応性LGL: 脾摘後やウイルス慢性感染症, 臓器移植後
・ClonaならばT-LGLLやCLPD-NK
・判断が困難ならば骨髄検査を行う.
LGL leukemiaやFelty症候群の治療
(Curr Opin Hematol. 2011 July ; 18(4): 254–259.)
・LGL leukemiaはIndolentな経過となり, 生存期間の中央値は10年以上.
主に血球減少やB症状, 脾腫による腹部症状に対して治療が行われる.
・LGL leukemiaもFSも免疫抑制療法が主となる.
・LGL leukemiaでは初期治療としてはMTX(10mg/m2/wk), CY 50-100mg/d, CsA 5-10mg/kg/dが選択されることが多い.
LGL leukemiaの50-60%で症状の緩和や血球減少の改善が期待できる
・FSではMTXなどDMARDにより好中球減少の改善が期待できる. 他にRTXやBioを使用した症例報告もあり. 治療反応を評価するには4ヶ月以上経過を見ることが推奨される.
・好中球減少に対してはG-CSFやGM-CSFも効果的.
・B症状改善にはGCが有用, 効果も迅速.
・脾腫による症状が強ければ脾摘も検討. FS患者の8割で迅速な好中球減少の改善が期待できる. LGLでも血球減少の改善は期待できる
LGL leukemia症例を対象としたPhase 2 trial.
(Leukemia (2015) 29, 886–894; doi:10.1038/leu.2014.298)
・ 初期治療をMTX 10mg/m2/wkの経口投与を行い, 反応不良であった患者でCYC 100mg/dに切り替え, 反応性を評価
・患者はLGL leukemiaと診断された群で, 末梢血CD3+CD57+ cell>400/µLもしくはCD8+ cell >650/µLを満たし, さらに以下の1つ以上を満たす群
・重度の好中球減少<500/µL
・再発性の感染を繰り返す好中球減少
・症候性の貧血 and/or 輸血依存の貧血
さらに, Bil<2.0mg/dL, GOT <1.5ULN, Cr<2.0mg/dL, ECOG 0-2, 他の悪性腫瘍がないことが条件.
・治療はMTX 10mg/m2/wk 経口投与. 4wkで1サイクル
. PSLは1mg/kgを30日間使用し, その後24日で減量・終了
・MTXへの反応が乏しい場合はCYC 100mg/d + 上記PSLレジメ
治療反応性の定義:
・CR: CBC正常 + LGL数やFCM結果が正常
・ PR: CRを満たさないが, ANC>500(>50%の上昇), Hb>1g/dLの上昇・輸血量の低下
アウトカム
・MTXで反応したのは CR+PRで38%[26-53]
・CYCで反応したのは CR+PRで64%[35-87]
2021年11月27日土曜日
関節リウマチにおける頚椎不安定症のリスク因子は?
RAにおける頚椎病変
(Current Rheumatology Reports (2020) 22: 19)
・RAは手指, 足指 末梢関節病変が主体となるが, 頚椎も多く傷害される部位である.
・RAの頚椎病変で最も炎症が多い部位がC1-C2(環軸椎)
この部位ではAAS(Atlanto-axial subluxation: 環軸椎亜脱臼)を生じる
・C3-C7領域の亜脱臼をSAS(Subaxial subluxation)と呼ぶ
・他にRAで認められる頚椎所見は, 椎間間隙の狭小化, 椎体や椎間関節の骨融解, 骨硬化像
・RAにおける頚椎病変は無症候〜神経圧迫による神経症状, 脳幹圧迫による突然死とかなり幅広い.
頚椎病変の画像評価
(Current Rheumatology Reports (2020) 22: 19)
AASの画像
・C1-C2の骨びらんや腱組織の障害により, 不安定化が生じる.
・不安定化で動く方向は, 前後, 左右, 上下, 回旋と さまざまな方向がある
前後方向の移動: XPでは, 正常位の側面像のみでは正常に見えることがあるため, 前屈させて評価することが必要.
・画像では正常位では間隔は2mmと正常であるが, 前屈させると6mmに拡大する.
・後屈も評価し, 動揺性を評価する.
・AASは脊髄圧迫による神経障害のリスクとなる
上下方向の移動:
・硬口蓋-後頭蓋下端を結んだ線をMcGregor lineと呼ぶ
・この線よりも4.5mm以上, 歯突起先端が上方にある場合, 上方向に亜脱臼をしていると判断する
・脳幹圧迫やStroke, 水頭症, 突然死のリスクとなる
左右方向の移動
・開口位で評価し, 左右対象性や骨びらん, 偏位を評価する.
・2mm以上偏位がある場合は亜脱臼と判断.
Subaxial subluxationの画像例
・前方偏位が多い. 3.5mmを超える偏位を有意とする
神経障害のリスクとなる
RAにおける頚椎病変の頻度
・報告により頻度は差があるが 最近の報告でも頻度は4割以上であるものも多い
・致命的なこともある一方, 無症状も多いため, しばしば評価自体忘れやすい
どのタイミングで評価すべきかも定まっていない.
・頚椎病変を認める患者のRA罹患期間は2.5-30.1年, 平均12.3年間.
RAにおける頚椎不安定症のリスクは?
生物学的製剤が治療の基本となった現代の頻度を評価した 国内のSingle-center cohort
(Mod Rheumatol, 2014; 24(6): 904–909)
・220例でMRI, 頚椎XPを評価したところ, 42%で頚椎不安定所見(+).
・頚部痛がなくても頚椎不安定性リスクは変わらない.
・リスク因子としては,
罹患期間が10年以上,
Steinbrocker stage III以上,
頚椎椎間板狭小化 3部位以上 が挙げられる
・治療薬: MTX, 生物学的製剤の使用有無は 頚椎不安定性のリスク因子とはならない
他の報告によるリスク因子のまとめ
地域, N | 有病率 | リスク因子 | 文献 |
イラク, | 7.4% | 発症期間 | Journal of Clinical Orthopaedics and Trauma 11 (2020) 876-882 |
韓国, | 28.6% | 手指XPの骨病変 OR 2.2[1.5-3.4] | Rheumatol Int (2011) 31:1363–1368 |
韓国, | - | AASのリスク | J Korean Neurosurg Soc 59 (6) : 590-596, 2016 |
多施設 | 基礎 41.3% | 基礎のムチランス変形 HR 19.2[4.0-92.6], | Spine (Phila Pa 1976). 2017 Apr 15;42(8):556-564. |
日本 | 106例(57%) AAS 79, VS 21, SAS 41 | GCの使用 2.8[1.3-6.0] bDMARDの使用 OR 2.5[1.1-5.7] | BMC Musculoskelet Disord. 2021 May 3;22(1):408. |
スペイン多施設 | AASは12%[9.7-14.2] | Larsen ≥50 OR 4.0[2.0-8.2] | Clinical and Experimental Rheumatology 2004; 22: 427-432. |
RA罹患期間とAAS有病率
(スペインの多施設研究[上記表の最後]より Clinical and Experimental Rheumatology 2004; 22: 427-432.)
------------------------------
RAの頚椎病変の有病率は高い可能性があるが, 無症候性も多くしばしば評価もされていないことも多い.
どのタイミングで評価すべきか, フォローすべきかは明確に決まっているわけではないが,
症状がある患者やリスクがある患者での評価は忘れないようにしたい.
・頸部痛や症状がある患者
・罹患後10年以上経過したRA
・疾患活動性が高く, 末梢関節の骨病変が顕著である患者群
は少なくとも必ずチェック, フォローしておいた方が良い.
2021年11月22日月曜日
溶連菌感染後 反応性関節炎
咽頭炎を罹患した後, 10日前後経過して急性に膝関節疼痛, 腫脹が出現した症例.
膝関節炎を認め, 咽頭培養より溶連菌が陽性, またASOも高度上昇が認められた.
他の考えられる疾患も除外され, 最終的に溶連菌感染後ReAと判断された.
溶連菌感染後反応性関節炎: Poststreptococcal Reactive Arthritis(PSRA)
・溶連菌感染後のReactive Arthritis.
・連鎖球菌感染後, 10日以内(2wk以内)に発症する無菌性関節炎.
・年齢ピークは2峰性で, 8-14歳, 21-37歳に多く, 成人で発症したPSRAではより長期間持続する傾向がある
・関節炎は下肢の大関節(主に膝関節)で多く, 単関節〜多関節とさまざま.
持続期間は2ヶ月前後.(範囲1週間〜8ヶ月)
・関節炎は侵襲性は低く, 関節変形を呈することは稀
腱鞘炎は1/3で認められる
(Current Rheumatology Reports (2021) 23: 19)(Rom J Morphol Embryol 2017, 58(3):801–807)
古典的ReAとPSRAの違い
・感染後〜発症までの期間がPSRAでは短く(1-2wk)
軸関節の侵襲は稀.
関節炎は通常2ヶ月程度で改善する例が多い.
・HLA-B27の関連はPSRAは少ない
(Current Rheumatology Reports (2021) 23: 19)
26名のRetrospective cohort (J Clin Rheumatol 2010;16:3-6)
・アラブ人18, アジア人8名, 男女比は12:14. 年齢は11-41yr.
・関節炎の前に上気道症状を認めたのは61%.
上気道症状〜関節炎発症までの期間は 10d-4wk. 2wkが最多.
・80%が左右非対称の症状を示す.
単関節炎が7.6%, Oligoarthritisが30.8%, 多関節炎が42.3%.
腱炎, 腱滑膜炎, 腱付着部炎のみを示すのが19.2%.
・ASOの平均値は624.8と高値. ESRは44mm/Hであった.
・NSAIDへの反応したのは84.6%. 15.4%がステロイド投与を要した.
関節炎の部位
PSRA Caseレポートのまとめ;
(Current Rheumatology Reports (2021) 23: 19)同様に溶連菌感染後に関節炎を呈する病態として, リウマチ熱(ARF)がある.
両者の違いはどのようなところだろうか?
リウマチ熱についてはこちらも参照: http://hospitalist-gim.blogspot.com/2015/08/blog-post_5.html
PSRA, ARFの比較
(Current Opinion in Rheumatology 2002, 14:562–565)・PSRAはARFよりも感染後短期間で発症し, 左右対称性の小関節病変が主となる点でARFと異なる.
・PSRAの関節炎は持続性, 非遊走性で, 2ヶ月[1wk-8M]持続. NSAIDへの反応性は緩徐.
ARFの関節炎は遊走性でNSAIDが著効. 2日程度で軽快する
・PSRAでも弁膜症は6%であり得るが, これには議論がある(後述)
(Perm J 2019;23:18.304)
日本国内の323施設からの後向きCohort.
(Allergology International 66 (2017) 617e620)
・2010-2015年に診断されたARF 44例とPSRA 21例のデータを解析
小児例が主
・炎症反応はARFで高く PR間隔延長が認められる
・ASOは双方とも1000台
・関節炎は ARFでは遊走性が6割. 分布は膝が多く, それはARFもPSRAも同等
・治療はAbx, NSAID, GC
PSRAの大半はGC無しで改善する. 2ヶ月を超えて関節炎を認めるのが3割弱
二次予防としてAbxを長期的に使用する例もある
68例のARFと159例のPSRA症例を比較 @イスラエル
(J Pediatr 2008;153:696-9)
・発熱を伴う頻度はARFの方が多い
関節炎の部位もARFでより多関節となり, 遊走性関節炎が79%と多い(vs 33%)
・炎症反応はARFで高くなる
・治療への反応性は ARFで迅速. 2日で改善する
PSRAでは1週間程度とより緩徐.
・PSRAでは再燃が21%と多い
・罹患関節の部位
主に下肢の大関節が両者ともにメインとなる.
ARFでは上肢の大関節にも生じやすい.
よりARFを疑う/否定する因子
・炎症が高いのはARFを疑うヒントとなる
・一方で関節症状がなかなか改善しない症例や, 再発する場合はARFよりもPSRAを考慮する
・NSAIDへの反応が良好で, 数日で改善するならばARFを疑う.
なかなか改善しない, 緩徐な経過となるならばPSRAの可能性が高い.
PSRAと心筋炎の関連
・PSRAはARFとは異なる疾患と考えられており, 心筋炎や弁膜症の合併も多くはない.
・弁膜症の合併についてはさまざま報告があり,
・イスラエルのPSRA 146例を3.6年フォローした結果, 心筋梗塞は認めず. 20例は心エコーにて軽度異常あり(mild-moderate MR 17, mild TR 2, mild AR 1) (Clin Exp Rheumatol. 2015;33:578–82.)
・イタリアの小児例PSRA 52例で, 6-10年後のフォローで心エコーで弁膜症は認められず. (Arthritis Rheum. 2009;60:3516–8)
・成人のPSRA 75例を平均8.9年フォローし, 心臓の異常は対象群と比較して有意差なし (Arthritis Rheum. 2009;60: 987–93)
関連性はいまいち分かっていないのが現状.
PSRAの治療
・溶連菌性咽頭炎の迅速な診断と治療はPSRAの予防となる
・関節炎に対するNSAIDへの反応性は低い. この点はARFとの有用な鑑別点となる.
・SASPやTNF阻害薬の効果はまだ明確ではない
・基本的に希少疾患であり, RCTの組み立ては難しいため, 経験的治療が主となっているのが現状.
NSAIDで治療が難しければ短期的なGC投与, DMARDの使用が考慮される.
2021年11月18日木曜日
SLEの疾患活動性の指標: SLE-DAS
SLEの治療目標は寛解, 低疾患活動性(LLDAS)であり,
LLDASは以下を満たすことで定義される
LLDAS: Lupus Low Disease Activity Stateで, 以下を満たす
・SLEDAI-2K ≤4で主要臓器の障害がなく, 且つ溶血性貧血や胃腸障害を認めない.
・主要臓器障害: 腎, CNS, 心肺, 血管炎, 発熱
・以前と比較して新しい臓器傷害を認めない
・SELENA-SLEDAI physician global assessment ≤1 (PGAはVAS: 0-3で評価)
・PSL投与量が≤7.5mg/d
・維持療法の免疫抑制剤投与量が安定している
・SLEDAI-2Kは過去10日以内の9臓器における障害を評価し計算.
(Ann Rheum Dis 2016;75: 1615–1621.)
LLDASは長期間維持することで, 新規臓器障害のリスクや再燃リスクは低下することがわかっている. (Arthritis Rheumatol. 2018 Nov;70(11):1790-1795.)(Lancet Rheumatol 2019; 1: e95–102)
2019年にSLEの活動性の指標として, 新たにSLE-DASが提唱された
(Ann Rheum Dis. 2019 Mar;78(3):365-371.)
2箇所の専門施設において, SLE 520例を評価.
PGA(Patient Global Assessment), SLEDAI 2Kと Cohortより作成したSLE-DASの有用性を評価
・SLEDAIと異なるところは,
皮膚粘膜障害のスコアが全身性血管炎よりも低く設定
皮膚障害も局所と全体でスコアを区別している
また, 稀だが重要な臓器障害をSLE-DASは含んでおり, 具体的には眼障害(Neuropsychiatricに含む), 心血管/肺障害, 消化管障害(Vasculitisに含む), 溶血性貧血が含まれているところ.
SLE-DASの各項目と計算式:
項目 | 内容 |
関節炎 | 28関節における腫脹関節を評価 |
局所的皮疹 | 頭頸部に限局した急性/亜急性/慢性経過の皮膚ループスによる皮疹(SLICC分類基準に含まれる) |
全身性の皮疹 | 頭頸部に限局しない上記皮疹 |
脱毛 | 局所的, 全身性の脱毛 |
粘膜潰瘍 | 口腔内, 鼻腔内潰瘍 |
全身性血管炎 | 大型, 中型血管炎, ループス腸炎 |
皮膚粘膜血管炎 | 皮膚粘膜血管炎全て. 凍瘡性ループス |
神経精神障害 | SLICC分類基準に含まれる神経精神症状:新規発症の痙攣, 精神症, 器質的脳障害, 急性意識障害), SLEによる網膜症, 末梢神経障害, 脊髄症, ループス頭痛, 脳血管障害, 無菌性髄膜炎 |
心臓/呼吸器障害 | 縮小肺, 間質性肺炎, びまん性肺胞出血, 肺高血圧症, 心筋炎, 弁膜症, Libman-Sacks心内膜炎 |
漿膜炎 | 無菌性の腹膜炎, 胸膜炎, 心外膜炎 |
筋炎 | CKやアルドラーゼ上昇, 筋電図, 筋生検で筋炎が示唆される, 近位筋の筋痛/筋力低下 |
蛋白尿 | PCR, 24時間蓄尿における蛋白尿 >500mg/g, >500mg/24h |
低補体血症 | C3 and/or C4の低下 |
抗ds-DNA抗体陽性 | 陽性 |
血小板減少 | PLT <10万/µL |
白血球減少 | WBC <3000/µL |
溶血性貧血 | 直接クームス試験陽性, LDHの上昇, ハプトグロビン低下を伴う貧血 |
SLE-DASとSLEDAI-2Kの臨床的判断に対する感度, 特異度
・SLE-DASの変化 ≥1.72は, SLEDA-2Kの変化 ≥4と比較して, 臨床的に改善, 増悪を判断する感度は良好であった結果.このSLE-DASの疾患活動性, 寛解状態に対応するカットオフを調査した報告
(Ann Rheum Dis 2021;80:1568–1574. doi:10.1136/annrheumdis-2021-220363)
SLE-DASにおける寛解のカットオフと SLE-DASの疾患活動性を評価するカットオフを 多施設Cohortにて評価した報告
・Padova Lupus Clinic(@伊), Cochin Lupus Clinic(@仏)におけるSLE症例(前向き)と, BLISS-76 trial(後ろ向き)における患者群を評価.
・検者は過去30日におけるPGAとSLEDAI-2K, SLE-DASを評価
・また臨床的寛解をDORISとDoriaにて評価(PSL ≤5mg/dにおいて)
Gold standardはDORIS基準とした.
・2施設では, SLEの専門医がDASや寛解状態をBlindした状態で, 検査所見や臨床所見より
(1)寛解, (2)軽度活動性, (3)中等度/高度活動性に分類(Clinical judgement)
・SLE-DASはオンラインで計算: http://sle-das.eu
DerivationはPadova Lupus Cohortのデータを用いて行い , 軽症, 中等症/重症活動性におけるSLE-DASのカットオフを評価.
・臨床的寛解は2つの定義を設定して評価
A) Index-based: PSL≤5mg/dにおいて, 専門医の臨床判断に対するSLE-DASのROC曲線から導き出せるSLE-DASの寛解上限値を満たすことで定義
B) Boolean-based: PSL≤5mg/dにおいて, SLE-DASのds-DNA抗体と低補体を除く全項目が陰性で定義
ValidationはCochin Lupus Cohortにおいて
・SLE-DASの臨床的寛解(A), (B)をDORIS基準をGold Standardとして評価
・SLE-DASの疾患活動性のカットオフを, 臨床評価をGSとして評価
BLISS-76のPost hoc analysisにおいて
・SLE-DASのカットオフにおける中等度/重度活動性疾患予測能を評価
GSはBILAG indexとし, BILAG domain ≥1B and/or ≥1Aで定義.
各母集団のデータ
アウトカム
・寛解で用いるSLE-DASのカットオフは2.08
中等度/重度活動性で用いるカットオフは7.64
・SLEの疾患活動性として,
寛解 ≤2.08, 軽度活動性 2.09~7.63, 中等度以上活動性 ≥7.64と設定すると良い
寛解の定義
・SLE-DASにおける臨床的寛解評価の感度, 特異度は良好.
・PSL ≤5mg/dの使用量において, SLE-DAS ≤2.08を寛解と判断することは合理的と言える.