・敗血症の定義は2001年以来の変更となる
・敗血症による臓器機能の変化, 形態学, 細胞生物学, 生化学, 免疫学, 病理など様々な側面より評価
・敗血症の主要な概念は以下のとおり
敗血症は感染に伴う死亡の主な原因.
敗血症は病原体の因子と患者本人の因子により生じる
敗血症による臓器障害は潜在性のこともある
敗血症の病態や臨床像は基礎疾患や合併症により変化することがある
一部の感染症では, 患者本人の全身性反応の惹起なく, 局所の臓器障害を呈する
(JAMA. 2016;315(8):801-810.)
敗血症(Sepsis)の定義(意訳あり)
・感染症に対する患者本人の無調節な免疫反応による, 致命的な臓器障害を呈する病態を敗血症と定義.
・臓器障害は急性のSOFA≥2点の変化で定義される.
ほとんどの患者では, SOFAの基礎値は0点となる.
初期には軽度の臓器障害のみで, 徐々に増悪した場合でも死亡リスクは高いため, 同様に扱うべきである
・感染症が疑われる患者で, 長期のICU管理が必要となりそう, もしくは瀕死状態の場合はベッドサイドでqSOFA(Quick SOFA)を評価する.
> qSOFAは以下の3項目で迅速に評価可能な臓器障害の指標:
呼吸数 ≥22回/分,
意識障害(GCS<14),
収縮期血圧 ≤100mmHg
・qSOFAは簡便で, 検査を必要としない指標であるが, 正確性はSOFAと比べて劣る. 感染症患者において, 迅速に敗血症を疑うきっかけとして用いる.
(JAMA. 2016;315(8):801-810.)
SOFAスコア
敗血症性ショック(Septic shock)の定義
・敗血症性ショックは, 敗血症の一部であり, 敗血症患者において, 循環動態, 細胞, 代謝機能の異常が重度であり, 大幅に死亡リスクが上昇する病態と定義.
・敗血症患者で十分な補液を行っているのにもかかわらず, MAP≥65mmHgを達成するために昇圧剤の投与が必要とする場合, 乳酸値>2mml/L(18mg/dL)の場合に敗血症性ショックと判断する.
・この場合の死亡リスクは40%以上となる
(JAMA. 2016;315(8):801-810.)
以下は同時に発表された補助的な論文のつまみ食い:
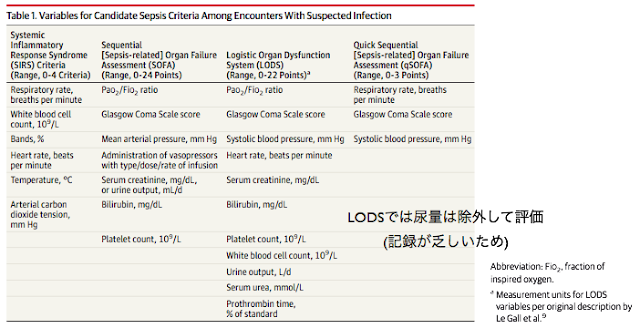
臓器障害の指標についての比較
ペンシルバニア南西部の12病院において,2010-2012年に診断された敗血症疑い患者を評価.
・これら患者群において, SOFAスコア, SIRSクライテリア, Logistic Organ Dysfunction system(LODS), qSOFAスコアと院内死亡率を評価.
ICU患者と非ICU管理患者における院内死亡率をアウトカムとした時のArea Under the Receiver Operating Curve
・SOFA, LODS双方がより死亡リスクを評価するのに適しており, SIRS, qSOFAよりも有用.
・SOFAとLODSでは特に差はなく, LODSの方が複雑であることを考えると, 死亡リスクを評価するための臓器障害評価にはSOFAが最適と言える
ちなみに, qSOFAの項目と院内死亡ORは以下のとおり
呼吸数 ≥22/分 OR 3.18[2.89-3.50]
収縮期血圧 ≤100mmHg OR 2.61[2.40-2.85]
意識障害(GCS<14) OR 4.31[3.96-4.69]
(JAMA. 2016;315(8):762-774.)
敗血症, 敗血症性ショックの定義と死亡リスク
感染症症例のMeta-analysisより, 敗血症性ショックの定義と死亡リスクを評価
・新しい敗血症性ショックの定義(Group 1)では院内死亡率が42.3%[41.2-43.3]
・Group 2: 乳酸値が満たさない場合は死亡率 30%
・Group 3: 輸液後低血圧(+)だが, 昇圧剤の使用はなく, 乳酸値>2mmol/Lの場合は死亡率 20-30%
・Group 4: 乳酸値>2mmol/Lのみで補液で血圧が反応した場合は死亡率 20-30%
・Group 5: 輸液前から血圧が保たれている場合で乳酸値 2-4mmol/Lでは30%
・Group 6: 輸液後低血圧(+)だが, 昇圧剤の使用はなく, 乳酸値≤2mmol/Lでは死亡率20%程度.
死亡リスクを見ると, G1 > G2~5 > G6となる.
(JAMA. 2016;315(8):775-787. )
・Group 2: 乳酸値が満たさない場合は死亡率 30%
・Group 3: 輸液後低血圧(+)だが, 昇圧剤の使用はなく, 乳酸値>2mmol/Lの場合は死亡率 20-30%
・Group 4: 乳酸値>2mmol/Lのみで補液で血圧が反応した場合は死亡率 20-30%
・Group 5: 輸液前から血圧が保たれている場合で乳酸値 2-4mmol/Lでは30%
・Group 6: 輸液後低血圧(+)だが, 昇圧剤の使用はなく, 乳酸値≤2mmol/Lでは死亡率20%程度.
死亡リスクを見ると, G1 > G2~5 > G6となる.
(JAMA. 2016;315(8):775-787. )