Pembrolizumab: キイトルーダ®, PD-1阻害作用を有する免疫チェックポイント阻害薬
200mgを3wk毎に投与. 1回あたり70万円強
この薬剤の多発性骨髄腫に対して使用したPhase 3 trialが2つ発表.
KEYNOTE-185, KEYNOTE-183
KEYNOTE-185: 未治療, 骨髄移植適応外の多発性骨髄腫症例において, Pembrolizumab+LD vs LD療法群に割り付け, 比較したopen-label RCT.
(Lancet Haematol. 2019 Sep;6(9):e448-e458. doi: 10.1016/S2352-3026(19)30109-7.)
・Lenalidomide: 25mgをDay 1-21,
Dexamethasone: 40mgをDay 1,8,15,22,
28日サイクル
・Pembrolizumab: 200mg 3wk毎
・患者は成人, 未治療, 移植適応外のMM. ECOG 0-1, 十分な臓器機能を有する群
母集団:
・StudyはN=640を目標としていたが, FDAにより途中で中止を指示
ProtocolへのAdherenceや安全性への懸念
中止の時点でのアウトカムには有意差はない
副作用
・Grade 3以上の重度の副作用はPembrolizumab群で多い.
・irAEと死亡に関連した副作用
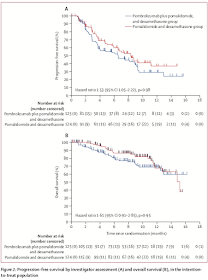
KEYNOTE-183: 再発性, 難治性MMに対するPembrolizumab + Pomalidomide + Dexを評価したRCT.
(Lancet Haematol. 2019 Sep;6(9):e459-e469. doi: 10.1016/S2352-3026(19)30110-3.)
・Pomalidomide: 4mgをDay 1-21,
Dexamethasone: 40mgをDay 1,8,15,22,
28日サイクル
・Pembrolizumab: 200mg 3wk毎
・患者は成人例のMMで過去2回以上の治療を行なったが不応, 再発した症例. ECOG 0-1を満たす群
・非分泌型や乏分泌型, MGUS, 形質細胞種, WM, 薬剤へのアレルギーを認める例は除外. 2年以内に全身性治療を有する自己免疫性疾患や間質性肺炎がある患者は除外. アミロイドーシス, か粘稠, POEMS, 繰り返す感染症症例も除外.
母集団
・300人を予定していたが, FDAより安全性の懸念が生じたため, 中断
アウトカム
・PFSはPD療法群で有意に良好. Pembrolizumabでは予後増悪
副作用頻度
irAE, 死亡に関連した副作用
-------------------------
血液領域では現時点でホジキンリンパ腫まで適応があるキイトルーダ®
多発性骨髄腫ではその効果よりも副作用による死亡リスク上昇の懸念が生じた結果であった.