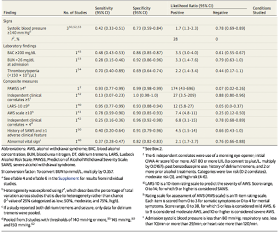
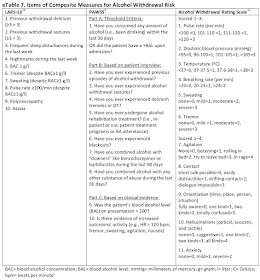
この分野で押さえておきたいStudyは, 寛解導入効果をシクロホスファミドと比較したRAVE-ITNとその続編
http://hospitalist-gim.blogspot.com/2013/11/anca.html
http://hospitalist-gim.blogspot.com/2016/06/ancapr3-anca.html
そして寛解維持治療として押さえておきたいのがアザチオプリンと比較したMAINRITSAN trial.
今回そのMAINRITSANの60ヶ月フォローの結果と,さらにリツキシマブの投与方法で比較したMAINRITSAN2が発表されたので紹介.
MAINRITSAN trial.
新規, 再燃性GPA, MPA, 腎限局型ANCA関連血管炎患者で, Cyclophosphamide+PSLで寛解を達成した115例を対象(GPA 87例, MPA 23例, 腎 5例)
(N Engl J Med 2014;371:1771-80.)
・Rituximab 500mgをDay 0, 14, 6ヶ月, 12ヶ月, 18ヶ月に投与する群とAzathioprineを使用する群に割り付け, 22ヶ月継続.
・アウトカムは28ヶ月時点での再燃率.
・Azathioprineは2mg/kg 12ヶ月, 1.5mg/kg 6ヶ月, その後1mg/kgへ減量
アウトカム:
・再発率はAZA群で29%, Rituximab群で5%と有意にRituximabで良好.
さらに, MAINRITSAN trialの60ヶ月フォローでもRTX群の方がより寛解維持, 生命予後が良い(Ann Rheum Dis 2018;77:1151–1157. )
AZA vs RTXの比較において, 60ヶ月における
・Major relapse-free survival 49.4%[38.0-64.3] vs 71.9%[61.2-84.6], p=0.003
・Minor, major relapse-free survival 37.2%[26.5-52.2] vs 57.9[46.4-72.2]
・Overall survival 93.0[86.7-99.9] vs 100
維持療法において, RTXを固定で使用するか, 患者毎に調節して使用するかを比較したRCT
MAINRITSAN2 trial: 初発, 再発性のGPA, MPAで寛解導入された症例を対象としたopen-label RCT.
(Ann Rheum Dis 2018;77:1144–1150. )
・患者毎に投与を決める群と, 固定投与群に割り付け, 経過をフォロー
・患者毎の投与群では, 初回に500mgを投与したのちは, CD19+ B細胞もしくはANCAが陽性化した際, またはANCAが著しく上昇した場合に500mgを追加投与する.
ANCAやCD19+ B細胞は3ヶ月毎にフォローし, 陰性化したANCAが陽性となった場合や, 2倍以上の増加を認めた場合, CD19+ B細胞>0/mm3を有意ととる. このレジメを18ヶ月継続
・固定投与群では, MAINRITSANと同様, 500mgをDay 0, 14, 6M, 12M, 18Mに投与する.
・アウトカムは28ヶ月における再燃
患者背景
・寛解導入はCYC,RTX,MTXなど
アウトカム
・28ヶ月の時点で, 再燃を認めたのが17.3% vs 9.9%, p=0.22
Relapse-free survivalは83.8%[76.1-92.3] vs 86.4%[79.2-94.2], p=0.58
major relapseは7.4% vs 3.7%, p=0.23
・GC投与量と期間は有意差なし
総量 4915±2613mg vs 4850±2444mg
期間 25.3M[23.9-26.6] vs 24.5M[22.8-36.3]
・RTX投与回数
3[2-4] vs 5[5-5]と有意に低下.
患者毎の調節群での投与回数の分布は, 1回(4.9%), 2回(28.4%), 3回(37%), 4回(18.5%), 5回(7.4%), 6回(2.5%), 7回(1.2%)
投与間隔は6.1M[3.1-9.2]
合併症
---------------------------
寛解維持はRTXがAZAに勝り, 長期的にもそれは持続.
またRTXは固定で行うよりも患者毎で投与を決める方が有意に回数は少なく済む.