前のブログで好塩基球増多, RA様症状で発症したCML,
またはRA患者とCMLの併発症例について勉強した.
それについて,
・血液腫瘍に合併する自己免疫性疾患は?
・CMLに合併する自己免疫性疾患は?
・CMLの治療はRAにも効くのか? という3点について.
① 血液腫瘍に合併する自己免疫性疾患は?
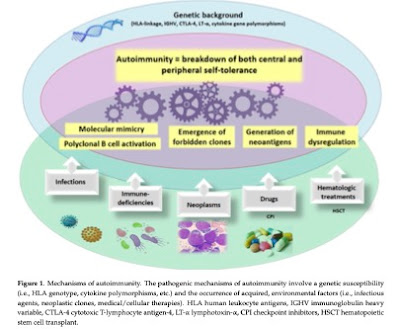
・血液腫瘍では自己免疫性疾患の合併は比較的多い. 有名なのはMDSに合併する関節炎や口腔/超粘膜病変, 好中球性皮膚症など. ITPやAIHAといった自己免疫性血球障害も多い.
・自己免疫性の障害は遺伝的要因(HLA, Ctokine polymorphismなど)と後天的な要因(感染や環境因子, 悪性クローン, 薬剤/治療など)により生じ, 血液腫瘍は免疫抑制や異常細胞により
自己免疫性疾患を合併するリスクは高いと考えられる
(Cancers 2021, 13, 1532)
リンパ増殖性疾患と自己免疫性血球障害
骨髄増殖性疾患と自己免疫性血球減少
リンパ増殖性疾患とAID(SLEやRAなど)の報告
骨髄増殖性疾患と自己免疫性疾患
・骨髄増殖性疾患と自己免疫性疾患の報告頻度はやはりMDSやCMMLが多い.
他のMPNやCMLは症例報告程度のみ.
② CMLに合併する自己免疫性疾患は?
・①の通り, CMLに合併する自己免疫性疾患は症例報告程度である.・スウェーデンにおけるCohort studyで, 2002-2012年に新規にCMLが診断された984例を解析し,
自己免疫性疾患, 他悪性腫瘍の既往を評価した報告では,
自己免疫性疾患はOR 1.55[1.21-1.98]とCMLのリスクとなる報告がある.
報告数はRAが多いが, 特にサルコイドーシスの関連性が高い. (Leukemia (2016) 30, 1562–1567; doi:10.1038/leu.2016.59)
・CMLに合併したリウマチ性疾患4例の報告とLiterature reviewでは,
4例はBD, RA, SpA, dcSSc症例であり,
発症の期間は7ヶ月〜12年と幅広い.
Literature reviewでは, RAが5例(うち1例はSS合併), SScが4例 (Rheumatol Int (2006) 26: 857–861)
これも, 偶発的なのか, 関連があるのかは不明確であると結論づけている.
症例報告からは,
・CMLに対してIFN療法, ヒドロキシウレア使用中に,
BD(再発性口腔内アフタ, 陰部潰瘍, 針反応, 発熱, 関節痛, 毛嚢炎)を呈した62歳女性の症例報告
コルヒチンの使用に反応したが, 3ヶ月後急性転化し, 敗血症で死亡
(American Journal of Hematology 66:57–58 (2001))
・36歳女性, 8年前にRAを診断. MTX+PSLで寛解し, 1年前に終了
PLT低下, 貧血, 多関節痛, 肝脾腫, 下肢の壊疽性膿皮症を発症し入院.
精査の結果CMLの急性転化と診断.
化学療法にて改善するが, 敗血症にて死亡した症例報告
(The Egyptian Rheumatologist (2013) 35, 1–4)
ということで, 報告はちらほらあるものの, 関連については不明確という状況.
③ CMLの治療はRAにも効くのか?
・CMLと合併したRAではTKI(イマチニブ)が関節症状にも有用という報告はちらほらある
・55歳の女性. 長期間のRA罹患があり, MTXとHCQにて治療されていた.
検査にて重度のPLT上昇, 好塩基球上昇があり, CMLを診断.
Imatinibにて治療が開始された.
6ヶ月後, DMARD無しでRAも寛解を達成.
(J Rheum Dis. 2011 Jun;18(2):118-121. Abstruct)
・74歳男性. 左中指のMTP腫脹, 両側膝関節腫脹, RF陽性にてRAを診断.
NSAIDと金製剤にて治療.
3年間のフォロー中にWBC 14-16000まで上昇するも原因不明と判断
5年後ILD発症し, 金製剤は中止. PSL 10mg/dまで増量
両側 膝関節, 手関節の腫脹と白血球上昇が持続するため紹介
WBC 25000-30000台, 好塩基球7%, 好酸球5%でありCMLを精査
肝脾腫は認めず.
膝・手関節以外は左肘関節の軽度拘縮, MCP, PIPの軽度腫脹,
XPにて両側橈骨頭のErosion, MTP関節のErosionを認めた.
WBC 26000(Eo 3.5%, Ba 9%), PLT 54.6万, Hb 13.0g/dL,
ESR 54mm/h, CRP 3.2mg/dL, ACPA 陰性
BCR-ABL遺伝子変異陽性であり, CMLと診断.
Imatinib 300mg/dが開始され,
1.5ヶ月後に肝障害を生じ200mgに減量.
WBCは1ヶ月後には9900, その後7200まで低下.
PLTも24.7万まで低下.
Imatinib開始後〜 患者の疼痛, 膝・手関節腫脹は改善傾向を示し
歩けるレベルまで低下.
CRPも0.3mg/dLまで低下
200mg/dに減量後はCRPは再度軽度の上昇を示したが,
その後300に再増量後は低下を認めた.
(Clin Rheumatol (2003) 22: 329–332)
・53歳女性. 11年前にRAを診断
MTX, Leflunomideで治療するも不応であり,
IFX→ADAを使用し治療するも不十分の状態であった
ADA開始後3年でWBC 5万台に上昇し, BCR-ABL陽性でCMLを診断
Imatinib 400mg/dで治療し, WBCは低下.
Imatinib開始後から関節症状も改善し, 6ヶ月後にはRA寛解.
その後21ヶ月の間, ImatinibのみでRAの寛解を維持
(DAS28 0.51, CRP, ESR正常)
(Joint Bone Spine 77 (2010) 366–375)
・54歳女性. RAに対してHCQ, 金製剤や, MTXで治療され,
一定の効果が認められていた.
罹患してからおよそ20年後にCMLを発症.
Imatinib 400mg/dにより治療され, その際MTXは中止
(相互作用による血中濃度の上昇を危惧)
3ヶ月後には血液学的寛解が得られ, その後も持続.
同時にRA症状も寛解を認めた.
MTX中止前よりも関節症状は改善.
(J Clin Rheumatol. 2009 Aug;15(5):267.)
CMLが改善したから, 関節症状が改善したのか, イマチニブ自体がRAに効くのだろうか?
イマチニブ自体のRAに対する効果は?
CMLと関係なく, RAに対してImatinibは有用であるとする報告は散見される.
・ImatinibはいくつかのTyrosine kinaseを阻害するTKI.
主にBCR-ABL, ABL, PDGFR, ARG, KITの阻害作用が判明している.
・ところが, それら遺伝子の異常がない症例に対しても, 一部で抗腫瘍効果を呈することがわかっている.
そのような症例を調べるとGDM1のCSF1R(Colony-stimulating factor 1 receptor)のエクソン12に変異があり, Imatinibにより脱リン酸化されることが判明した. (Leukemia (2009) 23, 358–364)
・CSF1RはType III receptor tyrosine kinaseであり, Monocyte/Macrophageの増生, 分化, 維持, 導入に関わる.
腫瘍のみではなく, RAの組織や細胞にも高発現しており, 炎症反応の促進やRAの滑膜細胞の増殖を促進する作用が認められる.
Imatinibは滑膜の炎症を濃度依存性に抑制することが動物実験で判明. (Clin Exp Immunol. 2019 Feb;195(2):237-250.)
ラットのCollagen-induced arthritisに対するImatinibの効果
・PBS: リン酸緩衝生理食塩水
・関節炎スコアや足の太さは
Imatinib投与群で有意に抑制される
(J. Clin. Invest. 116:2633–2642 (2006). doi:10.1172/JCI28546.)
第二世代TKIであるDasatinibでも同様に
ラットモデルでの関節炎抑制効果が認められる.
(Front Immunol. 2019 Jan 10;9:3133. doi: 10.3389/fimmu.2018.03133.)
同じく第二世代TKIのNilotinibも関節炎を抑制しうる
サイトカインの抑制作用を評価
・ImatinibはTNFα, IL-6, IFNγ, IL-17の抑制作用を呈する
>> 炎症性サイトカインと, T細胞誘導性サイトカイン.
・NilotinibはIFNγとIL-17のみ抑制.
IL-17抑制作用はNilotinibの方が強い
>> T細胞誘導性サイトカイン
(Mod Rheumatol (2011) 21:267–275)
ヒトに対する報告を見てみる
MTX 10mg以上PSL, さらに他のDMARDを使用しても,
活動性が高い*RA患者3例を対象とし, Imatinibを導入してフォローした前向きStudy.
(Ann Med 2003; 35: 362-367)
・*腫脹関節≥6で, 以下の2項目以上を満たす
1) 圧痛関節≥6,
2) CRP≥1.5mg/dL, ESR≥28mm/時
3) 45分以上持続する強い朝の強張り
・PSLは≤10mg/dを使用.
Imatinibと相互作用があると考えられる薬剤は4wk前に中止.
具体的にはMTXとシクロホスファミド.
1名シクロスポリン150mgを使用中の患者は50mgに減量し, 血中濃度をみつつ125mgまで増量
・3例ともInfliximabの治療歴があるが, 2名は副作用で中断, 1名は無効.
・Imatinibは200/dより開始し, 3-4wkに300/d, その後400mgとして合計12wk
アウトカム
・疼痛や活動性VAS,
炎症反応, RFは
Imatinib開始後に低下
・腫脹関節は全例で減少
. 疼痛関節は2例で減少
・ACR50達成が1例
, ACR20達成が1例,
ACR20未達成が1例
この3例のうち, 長期間Imatinibを継続した1例の長期フォロー
・20ヶ月後のXPでは, 骨病変の進行は認めず,
・14ヶ月後の滑膜生検では線維化と軽度の炎症所見を認めた. RAで認められるMast cellはほぼ認められず, TNF-α発現も少量のみであった
(J Clin Rheumatol 2008;14: 294–296)
RAに対するMasitinibを評価したPhase 2a study
(Arthritis Research & Therapy 2009, 11:R95 (doi:10.1186/ar2740))
・Masitinib: c-KIT阻害作用を有するTKI.
GISTの治療として用いられるが, 国内は未承認
他にPDGFRα/β, Lyn, Lck, FGFR3, FAKの阻害作用もあり
CSF1Rに対する阻害作用も認められる
・DMARDsでコントロール不十分なRA患者43例を対象とし,
Masitinib 3mg or 6mg/kg/dを12週間使用し, フォロー.
ACR20/50/70達成率を評価した.
・患者はMTX, TNF-α阻害薬をはじめとしたDMARDに不応, 効果不十分のRA患者で, 腫脹関節≥8, 疼痛関節≥10 且つ以下の1項目以上を伴う:
ESR ≥28mm/h, CRP ≥1.5mg/dL, 45分以上持続する朝の強張り.
・除外項目は骨髄障害(Neu<2500, PLT<10万), 活動性感染症, 入院が必要な感染症の既往, 2wk以内の抗菌薬使用
アウトカム
・12週間におけるACR20は55.6%で達成.
ACR50は33.3%, ACR70は11.1%
・抗TNFα阻害薬に不応であった患者でも57%でもほぼ同等の効果
・DAS28<2.6達成できた症例は少ない.
長期的なアウトカム(~84wk)
・長期的にはACR90や寛解を達成する患者は増加
RAではなく, SpAに対しても有用である報告がある
SpA患者に対するImatinib
6例のSpA(AS 3, Juvenile AS 1, PsA 2)を対象
全例で末梢関節罹患あり
4例で脊椎の疼痛, 3例で仙腸関節炎の画像所見陽性
(Rheumatology 2006;45:1575–1576)
・NSAID, PSL, MTXとSASPで治療し, 効果不十分.
BASDAI ≥4, 末梢関節炎(腫脹/疼痛関節≥4)を満たす.
・この6例に対してImatinibを追加.
200mg/dより開始し, 4wk後に400mgに増量.
3ヶ月継続し, 疾患活動性をフォロー
アウトカム:
・3ヶ月後の関節症状, 疼痛, 腱付着部炎,
夜間の疼痛, 疾患活動性VAS, 炎症反応すべて改善あり.
----------------------------------
CMLとRAが合併しやすいかどうかはまだよくわからないものの, 双方とも比較的多い専門疾患であり, CMLの増悪とともに関節症状の増悪を伴う症例報告もあることから, 頭の片隅に置いておこう.
CMLに使用される第一世代TKI(イマチニブ), 第二世代TKI(ダサチニブ, ニロチマブ)はRAを始めとした自己免疫性炎症性関節炎にも有用な可能性があり, 両者を合併した症例ではTKIを使用しつつ, 元々のDMARDを減量, 中止にもってゆくことが可能かもしれない.