The American Journal of Medicine (2016) 129, 1082-1092 より
デンマークにおいて, 140例の自己免疫性甲状腺機能低下症患者と年齢, 地域を合わせた560例のControl群において,自覚症状を評価し比較.
・症状は<50歳, 50-59歳, ≥60歳の3群で比較した.
・自覚症状は質問表を用いて, 甲状腺機能低下症が診断される12ヶ月以内に認めた症状をチェックする.
・症状は論文報告より, 関連性がある13症状を評価
頸部症状(腫大, 嚥下困難, 前頸部痛),
呼吸器症状(Wheezing, 呼吸苦),
心臓症状(動悸),
消化管症状(便秘),
皮膚症状(Hair loss, 皮膚過敏, 乾燥),
精神症状(Restlessness, 気分障害),
倦怠感 の13項目.
また, 最近のめまい, ふらつきの有無も評価.
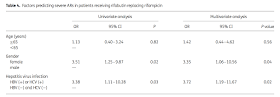
アウトカム: 症状の数は, 高齢者ほど少ない.
・70歳以上では, コントロール群と症状の数は変わらない.
・<50歳では, 症状が多ければ積極的に疑うが, ≥60歳では症状が多くても甲状腺機能低下症の可能性を上げるわけではない.
症状別の評価
(A: <50歳, B: ≥60歳. ● 甲状腺機能低下症, ○ Control群)
≥60歳でControl群と比較して有意差を認める項目は,
・疲労感
・呼吸苦
・Wheezing の3項目
----------------------------
「甲状腺機能低下症」でよく見られる症状は若年〜中年発症例では目立つが, 高齢者の甲状腺機能低下症では典型的な症状とはならない.
高齢者の甲状腺機能低下症で有意に多いのは疲労感や呼吸苦、Wheezeである結果.
たしかに, 高齢者では症状がイマイチはっきりせず, 不定愁訴のスクリーニングとして評価して引っかかったことや, かなり疑って外すことも少なからず経験します.
にしてもWheezeかぁ、、これはあまり引っ掛けたことはないですけど.
特に専門は絞っていない内科医のブログ *医学情報のブログです. 個別の相談には応じられません. 現在コメントの返事がうまくかけませんのでコメントを閉じています. コメントがあればFBページでお願いします
ページ
▼
2016年9月30日金曜日
2016年9月28日水曜日
補液負荷への反応性を評価する指標(JAMA Rational Clinical Examinationシリーズ)
JAMAのRational clinical examination より, 補液負荷に対する反応性を予測する指標についてのMeta-analysisがでました.
(JAMA. 2016;316(12):1298-1309.)
補液反応性のイメージ図: 前負荷と心拍出量
補液は前負荷を増やすという処置であり, それに伴いSVが上昇し, 循環が改善することを補液反応性ありと評価する.
すでに前負荷が十分であったり, 心臓のポンプ機能が低下している場合は補液反応性が低く, このような病態をどう予測するかが臨床上重要.
Meta-analysisの結果から
(JAMA. 2016;316(12):1298-1309.)
補液反応性のイメージ図: 前負荷と心拍出量
補液は前負荷を増やすという処置であり, それに伴いSVが上昇し, 循環が改善することを補液反応性ありと評価する.
すでに前負荷が十分であったり, 心臓のポンプ機能が低下している場合は補液反応性が低く, このような病態をどう予測するかが臨床上重要.
Meta-analysisの結果から
|
指標
|
|
Cut off
|
感度(%)
|
特異度(%)
|
LR+
|
LR-
|
|
CVP
|
|
8mmHg(6-9)
|
62[54-69]
|
76[60-87]
|
2.6[1.4-4.6]
|
0.50[0.39-0.65]
|
|
脈圧変動
|
VT≥7.0mL/kg群
|
11(4-15)
|
84[75-90]
|
84[77-90]
|
5.3[3.5-8.1]
|
0.19[0.12-0.30]
|
|
|
VT<7.0mL/kg群
|
8(5-12)
|
72[61-81]
|
91[83-95]
|
7.9[4.1-16]
|
0.30[0.21-0.44]
|
|
SV変動
|
人工呼吸群
|
13(10-20)
|
79[67-87]
|
84[74-90]
|
4.9[2.8-8.5]
|
0.25[0.15-0.43]
|
|
|
自発呼吸群
|
10-12
|
57-100
|
44-57
|
1.0-2.3
|
0.05-0.98
|
|
IVC変動
|
人工呼吸群
|
15(12-21)
|
77[44-94]
|
85[49-97]
|
5.3[1.1-27]
|
0.27[0.08-0.87]
|
|
|
自発呼吸群
|
40-42
|
31-70
|
80-97
|
3.5-9.3
|
0.38-0.71
|
|
下肢挙上試験
|
CO変動を評価
|
11(7-15)
|
88[80-93]
|
92[89-95]
|
11[7.6-17]
|
0.13[0.07-0.22]
|
|
|
PP変動を評価
|
10(9-12)
|
62[54-70]
|
83[76-88]
|
3.6[2.5-5.4]
|
0.45[0.36-0.57]
|
|
下肢挙上試験
(CO変動を評価) |
人工呼吸群
|
10(7-12)
|
92[82-97]
|
92[86-96]
|
11[6.3-21]
|
0.08[0.03-0.21]
|
|
自発呼吸群
|
12(10-13)
|
88[80-94]
|
88[80-94]
|
7.0[3.8-13.1]
|
0.22[0.09-0.54]
|
脈圧, SV, IVC変動は呼吸性変動. 吸気, 呼気での変動率(%)を評価.
IVC変動は呼吸性変動における, (最大IVC径 - 最小IVC径)/最大IVC径 x100
脈圧, SVは分母は平均値となる(後述)
IVC変動は呼吸性変動における, (最大IVC径 - 最小IVC径)/最大IVC径 x100
脈圧, SVは分母は平均値となる(後述)
IVCの評価
Passive Leg-Raising Test: 下肢を45度挙上し, 前負荷を増やし, それに伴うCOやSVの上昇を評価する.
・COの上昇は60秒以内に生じることがほとんど.
・変動は上昇値を(%)で評価する.
呼吸による脈圧(PP)変動.
・陽圧換気では, 吸気時に胸腔内圧が上昇するため, 前負荷が低下.
・前負荷が低下することで, 吸気時終末〜呼気時にはSV, BP, 脈圧が低下する.
・脈圧変動(PPV)は以下の式で計算:
(最大PP-最小PP)/[(最大PP+最小PP)/2]x100
身体所見では補液反応の予測は困難であった.
・2つのStudyで身体所見による予測能を評価.
1つは粘膜乾燥, 腋窩乾燥, Turgor低下, CRT>2sec, 頻脈, JVPを評価
もう一つはTurgor, CRT, JVD, 粘膜乾燥, 聴診所見, 浮腫, 腹水, 胸水を評価したが, LRは1前後と有意な所見ではなかった.
どのようなStudyか見てみると,
成人例の重症熱帯マラリア 28例における, 身体所見と補液反応性の関係を評価.
(Malaria Journal 2013, 12:348)
ICU患者24例において, 身体所見と補液反応性の関係を評価
(Journal of Critical Care (2013) 28, 537.e1–537.e9)
・補液反応性は, 7ml/kgの外液を30分で投与した際, CI ≥15%の上昇で定義
・母集団は肝硬変, 急性肝炎患者, 肺炎患者が多い.
身体所見の評価項目と補液反応性に対する予測能
・身体所見は項目別ではなく, 総じての評価となる
----------------------------------
補液負荷に反応するか, という判断はICU管理や救急診療で重要.
個人的にはエコーを多用することが多く,
「負荷して害にならない」ならばまず負荷して各種パラメータを評価している.
身体所見がアテにならない, という結果はとても残念だが, そこを評価したStudyはまだまだ小規模であり, この結果だけで判断はできない印象.
所見とエコーで簡便に, リアルタイムで評価, フォローできるようなアルゴリズムが作れるとよいのですけど。
多分この辺は各人が独自のアルゴリズムを自然に持っているのではないでしょうか?
2016年9月26日月曜日
リファンピシンとリファブチンの交差反応は?
リファンピシンとリファブチンはリファマイシン系の抗生剤で, 結核や非結核性抗酸菌症でコアとなる薬剤の1つと言える.
通常リファンピシンをよく使用するが, CYP3A4誘導による様々な薬剤との相互作用や副作用が多いため, 継続できない患者もいる.
副作用で継続できない場合, リファンピシンの脱感作療法を試すか, リファブチンへの変更, もしくは他のレジメを試すことになるが,
リファンピシンが副作用で継続できない場合, リファブチンで交差反応をきたすリスクはどの程度あるのか?
単一施設において, 2006-2010年に新規治療開始されたTB 2868例(非HIV合併例)を後ろ向きに評価.
(J Antimicrob Chemother 2014; 69: 790–796)
・このうち221例(8%)が副作用によりリファンピシンからリファブチンへ変更された.
・変更されたうち158(72%)は副作用なくリファブチンを継続.
47例(21%)は軽度の副作用, 16(7%)は重度の副作用(好中球減少, 肝炎, ぶどう膜炎)を発症し, リファブチンを中止する必要があった.
リファンピシンにて,
皮疹を生じた場合,
肝障害を生じた場合,
関節痛を生じた場合はリファブチンでも同様の副作用が出現するリスクが高い.
また, 女性例やHBV, HCV陽性例では副作用を生じるリスクが高い.
HIV合併TB症例において, リファンピシンによるDRESSを合併した88例中, リファンピシンの再投与でDRESS再発したのが19例.
・再投与時にはパッチテスト, Skin prick test, 経口チャレンジ試験を行い, 再投与を決める.
・19例中, リファブチンへ変更した6例の解析.
リファンピシン再投与での副作用は, 皮疹が6/6, 好酸球増多が5/6, 肝炎が4/6, 浮腫が3/6, 発熱, 低血圧, 下痢が1例
リファブチンに変更した6例全例でDRESSの発症は認められない結果.
リファンピシン→リファブチン変更時の交差反応リスクについてはまだ報告が多くはない.
皮疹, 肝障害, 関節炎といったDRESSでは十分な注意が必要と考えられるが, 副作用なく使用できる可能性も高い.
論文ないの言及はありませんが、SJSやTENではそもそもリファブチンへの変更も避けると思いますし、自分も避けますね...
通常リファンピシンをよく使用するが, CYP3A4誘導による様々な薬剤との相互作用や副作用が多いため, 継続できない患者もいる.
副作用で継続できない場合, リファンピシンの脱感作療法を試すか, リファブチンへの変更, もしくは他のレジメを試すことになるが,
リファンピシンが副作用で継続できない場合, リファブチンで交差反応をきたすリスクはどの程度あるのか?
単一施設において, 2006-2010年に新規治療開始されたTB 2868例(非HIV合併例)を後ろ向きに評価.
(J Antimicrob Chemother 2014; 69: 790–796)
・このうち221例(8%)が副作用によりリファンピシンからリファブチンへ変更された.
・変更されたうち158(72%)は副作用なくリファブチンを継続.
47例(21%)は軽度の副作用, 16(7%)は重度の副作用(好中球減少, 肝炎, ぶどう膜炎)を発症し, リファブチンを中止する必要があった.
リファンピシンにて,
皮疹を生じた場合,
肝障害を生じた場合,
関節痛を生じた場合はリファブチンでも同様の副作用が出現するリスクが高い.
また, 女性例やHBV, HCV陽性例では副作用を生じるリスクが高い.
HIV合併TB症例において, リファンピシンによるDRESSを合併した88例中, リファンピシンの再投与でDRESS再発したのが19例.
・再投与時にはパッチテスト, Skin prick test, 経口チャレンジ試験を行い, 再投与を決める.
・19例中, リファブチンへ変更した6例の解析.
リファンピシン再投与での副作用は, 皮疹が6/6, 好酸球増多が5/6, 肝炎が4/6, 浮腫が3/6, 発熱, 低血圧, 下痢が1例
リファブチンに変更した6例全例でDRESSの発症は認められない結果.
リファンピシン→リファブチン変更時の交差反応リスクについてはまだ報告が多くはない.
皮疹, 肝障害, 関節炎といったDRESSでは十分な注意が必要と考えられるが, 副作用なく使用できる可能性も高い.
論文ないの言及はありませんが、SJSやTENではそもそもリファブチンへの変更も避けると思いますし、自分も避けますね...
2016年9月23日金曜日
抗生剤の持続投与 vs 間欠投与の比較: メタアナリシス
以前,
ICUにおける抗生剤の持続静注
で抗生剤の持続投与群 vs 間欠投与群を比較したRCTを紹介した.
さらに以下のRCTが2016年に発表されている
Intensive Care Med. 2016 Jan 11. [Epub ahead of print]
Beta-Lactam Infusion in Severe Sepsis (BLISS): a prospective, two-centre, open-labelled randomised controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis.
残念ながら読めない...
この3つのRCTをMeta-analysisで解析した論文
(Am J Respir Crit Care Med Vol 194, Iss 6, pp 681–691, Sep 15, 2016)
重症敗血症患者のICU管理において, βラクタム系抗生剤の持続投与 vs 間欠投与を比較した3 RCTs (N=632)を対象にMeta-analysisを施行.
・持続注射は24時間継続で定義
・間欠投与は1回あたり30分以下の時間で投与する
・30日死亡リスク, ICU死亡リスク, ICU滞在期間, 臨床的改善(抗生剤終了後7-14日後の症状消失で定義)を比較.
母集団データ
アウトカム
・30日死亡リスクは持続投与群で低下する結果
・ICU滞在期間は有意差なし
・臨床的改善も有意はないが, 持続投与群でやや良好?
サブ解析
・APACHE II≥22, RRT使用ない患者群では, 持続投与で臨床的改善が増加.
・PIPC/TAZ使用や培養陰性では持続投与により30日死亡リスクの低下, 臨床的改善の増加が見込める
------------------------
未だ持続投与 vs 間欠投与論争に夜明けは見えそうもありませんね.
Beta-Lactam Infusion in Severe Sepsis (BLISS): a prospective, two-centre, open-labelled randomised controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis.
残念ながら読めない...
この3つのRCTをMeta-analysisで解析した論文
(Am J Respir Crit Care Med Vol 194, Iss 6, pp 681–691, Sep 15, 2016)
重症敗血症患者のICU管理において, βラクタム系抗生剤の持続投与 vs 間欠投与を比較した3 RCTs (N=632)を対象にMeta-analysisを施行.
・持続注射は24時間継続で定義
・間欠投与は1回あたり30分以下の時間で投与する
・30日死亡リスク, ICU死亡リスク, ICU滞在期間, 臨床的改善(抗生剤終了後7-14日後の症状消失で定義)を比較.
母集団データ
アウトカム
・30日死亡リスクは持続投与群で低下する結果
・ICU滞在期間は有意差なし
・臨床的改善も有意はないが, 持続投与群でやや良好?
サブ解析
・APACHE II≥22, RRT使用ない患者群では, 持続投与で臨床的改善が増加.
・PIPC/TAZ使用や培養陰性では持続投与により30日死亡リスクの低下, 臨床的改善の増加が見込める
------------------------
未だ持続投与 vs 間欠投与論争に夜明けは見えそうもありませんね.
2016年9月22日木曜日
起立性頻脈症候群 Postural Orthostatic Tachycardia Syndrome(POTS)
起立性頻脈症候群. POTS.
POTSとは, 起立や上体挙上に伴い, HRが上昇し, 慢性経過の起立不耐症を生じる病態.
・HRは上昇するが, 血圧は低下しない点が起立性低血圧と異なる.
・定義としては, チルト試験にて10分以内にHRが30bpm以上上昇し, 血圧の低下はsBP20mmHg以下, dBP10mmHg以下であることで定義
・小児の場合は生理的に起立生頻脈を生じるため, ≥40bpmをカットオフとしたほうが良い.
・また, 慢性経過(6ヶ月以上)の起立時の前失神が認められる.
HRの変動のみで診断はせず, 6ヶ月以上HRの変動持続し, さらに症状を認める場合にPOTSを考慮する.
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
POTSは米国では50万〜300万人いると考えられている
・男女比は 1:4~5と女性に多い. 女性に多い理由は不明
・80-85%が13-50歳の女性で発症する.
・9歳未満での発症は稀
・QOLの低下や仕事能の低下に関与する.
・また, 起立時のHRの上昇は朝, 午前中のほうが顕著となる
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)(JAAPA. 2016 Apr;29(4):17-23.)
Mayo clinicの152名のReviewでは
(Mayo Clin Proc 2007;82:308-13)
・平均年齢 30.2yr(10.3), 女性が86.8%
・発症~診断まで平均4.1yrを要する
・発症は急性(<1mo) ~ >3moと一定していない
・発症トリガーとして, Viral Infection, 術後が27.6%である (Viral Infectionが90%以上を占める)
POTSの機序
POTSは複数の機序が関連している.
・自律神経の障害
・循環血液量の減少, R-A-A系の抑制
・中枢性の高アドレナリン状態
・ノルアドレナリン輸送体の欠損
・肥満細胞の活性化
・自己免疫性, 自己抗体: α1 adrenergic receptor(AR)に対する抗体が検出されている報告もある.
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
POTSの症状
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
起立時の症状:
・頻脈性の動悸, ふらつき, 胸部不快感, 呼吸苦など心臓に関連する症状や
意識混濁, 頭痛, 悪心, 振戦, 全身脱力感, 複視, 視野狭窄など非心臓症状
・失神を認めるのはPOTSの30%程度のみ.
・立位時に循環血液量の減少が生じるため, 四肢末端のチアノーゼ所見が認められることもある
(JAAPA. 2016 Apr;29(4):17-23.)
・頻脈は洞性頻脈であり, ECGやHolter心電図は不整脈除外に有用.
心エコーも心筋症評価目的に使用する.
非起立性症状
・POTS患者では起立時以外の症状も認められるが, 特異的とは言い難い.
症状は自律神経由来のものも, それ以外の機序もある.
・消化管症状: 腹痛や悪心嘔吐, IBS
膀胱症状
発汗障害
運動耐用量の低下
睡眠障害
片頭痛様頭痛
倦怠感 など
うつ病や不安症状も併発する
・不安症状としても頻脈や震え, 過換気などはあるが, POTSは不安症状と関係なく症状が誘発される
POTSの症状は急性のストレス(感染, 妊娠, 外傷, 手術など)を契機に出現し, また日常生活(長時間の立位, 運動, 食事, 飲酒, 嚥下, 気温の変化)で増悪することがある
Mayo clinicの152名の症状頻度
(Mayo Clin Proc 2007;82:308-13)
POTSとは, 起立や上体挙上に伴い, HRが上昇し, 慢性経過の起立不耐症を生じる病態.
・HRは上昇するが, 血圧は低下しない点が起立性低血圧と異なる.
・定義としては, チルト試験にて10分以内にHRが30bpm以上上昇し, 血圧の低下はsBP20mmHg以下, dBP10mmHg以下であることで定義
・小児の場合は生理的に起立生頻脈を生じるため, ≥40bpmをカットオフとしたほうが良い.
・また, 慢性経過(6ヶ月以上)の起立時の前失神が認められる.
HRの変動のみで診断はせず, 6ヶ月以上HRの変動持続し, さらに症状を認める場合にPOTSを考慮する.
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
POTSは米国では50万〜300万人いると考えられている
・男女比は 1:4~5と女性に多い. 女性に多い理由は不明
・80-85%が13-50歳の女性で発症する.
・9歳未満での発症は稀
・QOLの低下や仕事能の低下に関与する.
・また, 起立時のHRの上昇は朝, 午前中のほうが顕著となる
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)(JAAPA. 2016 Apr;29(4):17-23.)
Mayo clinicの152名のReviewでは
(Mayo Clin Proc 2007;82:308-13)
・平均年齢 30.2yr(10.3), 女性が86.8%
・発症~診断まで平均4.1yrを要する
・発症は急性(<1mo) ~ >3moと一定していない
・発症トリガーとして, Viral Infection, 術後が27.6%である (Viral Infectionが90%以上を占める)
POTSの機序
POTSは複数の機序が関連している.
・自律神経の障害
・循環血液量の減少, R-A-A系の抑制
・中枢性の高アドレナリン状態
・ノルアドレナリン輸送体の欠損
・肥満細胞の活性化
・自己免疫性, 自己抗体: α1 adrenergic receptor(AR)に対する抗体が検出されている報告もある.
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
POTSの症状
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
起立時の症状:
・頻脈性の動悸, ふらつき, 胸部不快感, 呼吸苦など心臓に関連する症状や
意識混濁, 頭痛, 悪心, 振戦, 全身脱力感, 複視, 視野狭窄など非心臓症状
・失神を認めるのはPOTSの30%程度のみ.
・立位時に循環血液量の減少が生じるため, 四肢末端のチアノーゼ所見が認められることもある
(JAAPA. 2016 Apr;29(4):17-23.)
・頻脈は洞性頻脈であり, ECGやHolter心電図は不整脈除外に有用.
心エコーも心筋症評価目的に使用する.
非起立性症状
・POTS患者では起立時以外の症状も認められるが, 特異的とは言い難い.
症状は自律神経由来のものも, それ以外の機序もある.
・消化管症状: 腹痛や悪心嘔吐, IBS
膀胱症状
発汗障害
運動耐用量の低下
睡眠障害
片頭痛様頭痛
倦怠感 など
うつ病や不安症状も併発する
・不安症状としても頻脈や震え, 過換気などはあるが, POTSは不安症状と関係なく症状が誘発される
POTSの症状は急性のストレス(感染, 妊娠, 外傷, 手術など)を契機に出現し, また日常生活(長時間の立位, 運動, 食事, 飲酒, 嚥下, 気温の変化)で増悪することがある
Mayo clinicの152名の症状頻度
(Mayo Clin Proc 2007;82:308-13)
| 起立性 | 頻度 | 非起立性 | 頻度 | 全身症状 | 頻度 |
| ふらつき | 77.6% | 鼓腸 | 23.7% | 倦怠感 | 48.0% |
| Presyncope | 60.5% | 嘔気 | 38.8% | 睡眠障害 | 31.6% |
| 脱力 | 50.0% | 嘔吐 | 8.6% | 片頭痛 | 27.6% |
| 動悸 | 75.0% | 腹痛 | 15.1% | 筋肉痛 | 15.8% |
| 振戦 | 37.5% | 便秘 | 15.1% | 神経痛 | 2.0% |
| 呼吸苦 | 27.6% | 下痢 | 17.8% | ||
| 胸痛 | 24.3% | 排尿障害 | 9.2% | ||
| 無汗 | 5.3% | 瞳孔障害 | 3.3% | ||
| 発汗過多 | 9.2% | ||||
| 体温上昇により増悪 | 53.3% | ||||
| 運動により増悪 | 53.3% | ||||
| 食事により増悪 | 23.7% | ||||
| 月経により増悪 | 14.5% |
POTSの診断
(Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
起立時, チルト試験でのHR上昇が認められ, 起立時の症状が6ヶ月以上持続する.
・さらに症状は臥位で改善する.
・また, 様々な全身疾患や薬剤で生じる可能性もあるため, それらの除外が重要.
POTSと鑑別が必要な病態, 疾患
(JAAPA. 2016 Apr;29(4):17-23.)
Vasovagal Syncope
・失神を生じる状況が似ているため, VVSとの鑑別は重要.
・チルト試験が鑑別で有用な検査.
・VVSでは挙上後しばらくはBPを保てるが, その後急激に低下する
・POTSではBPの低下は認められず, HRが上昇する.
Inappropriate Sinus Tachycardia(IST)
・若年女性に多く, HR上昇に伴い前失神を生じる.
・POTSとの違いはHR上昇が体勢に依存しない点.
安静時のHRも100を超えることが多い
POTSを合併しやすい疾患 (Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
(JAAPA. 2016 Apr;29(4):17-23.)
慢性疲労症候群(CFS)
・POTSの患者では, 睡眠の質が低下し, 日中の眠気, 倦怠感, QOLが低下する.
・CFSは原因が明らかではない慢性経過の疲労感を特徴とする.
また, POTSと同様, 女性で多い.
・POTSを満たす患者において, 慢性の倦怠感を伴うのは48-77%
CFSの基準を満たすのは17-23%で認められる.
・POTSとCFSはオーバーラップしており,CFSとPOTSはそれぞれの一部症と考える専門医もいる.
CSFクリニックでCSFと診断された306例中, POTSの基準を満たしたのは33例(11%)
(J Intern Med 2014; 275: 409–417. )
・CSF-POTS合併例のほうがより若年, 立位での仕事時間が短くなる.
QOL低下もより高度
Ehlers-Danlos Syndrome(EDS)
・EDSは結合織の異常をきたす先天性疾患であるが, EDS III型は自律神経機能異常を伴う頻度が高く, POTSに類似した症状を呈する.
・起立時の頻脈, ふらつき, 前失神など
また, 運動や食事, 環境でも症状が誘発されることもPOTSに類似.
・POTS患者のうち, 18%がEDSの基準を満たす.
一般人口では0.02%, POTSを満たさない自律神経症患者群では4%.
・EDS III型は最もPOTSに関連している病態と考えられている.
POTSの治療 (Curr Neurol Neurosci Rep. 2015 Sep;15(9):60.)
非薬物治療
・水分摂取と塩分摂取: 1日あたり2-3Lの水分摂取と, >200mEq/dのNa(塩分換算で11.8g)摂取を推奨.
・腹部を圧迫するようなバンドも有用とされる
・運動療法: POTSでは運動中もHR上昇が著しく, 症状を認める.
有酸素運動を筋力トレーニングを行うことで, 心拍出量を増加させ, 運動中のHR過剰上昇や症状を抑制する効果が期待できる
運動は最初は座位や臥位で行うことがポイント.
また, 効果が実感できるまでは5-6週間はかかることを患者に伝える.
運動療法 (Hypertension 2005;45:391-8)
・20代健常人(米軍新入隊者 2655名)中, 36名(1.4%)がOrthostatic intoleranceあり(Tilt-table testにてΔHR>30)
・31名を3カ月間のジョギング vs ControlにRandom割り付けし, 再評価
・ジョギング群では6/16がTilt-table test陽性, Control群では10/11がTilt-table test陽性のまま. (p値=0.008)
薬物治療
・薬物治療についてはRCTはなく, POTSの機序も, その判断も不明瞭なため選択が難しい.
・非選択性β阻害薬や, Midodrine, オクトレオチドなど様々なものが試される.
Mayoのコホートでは, 補液によるVol.の改善がほとんどの症例で施行されている
β-blockerは76.7%で処方. 他には, 以下のものが試される
| Drug | 頻度 | Drug | 頻度 |
| Fludrocortisone | 39.5% | Clonidine | 11.8% |
| Midodrine | 31.6% | Pyridostigmine | 5.3% |
| SSRI | 51.7% | Resistance training | 71.0% |
| Phenobarbitone | 16.0% | Pressure stocking | 10.7% |
| Acetazolamide | 4.2% |
(Mayo Clin Proc 2007;82:308-13)
小児例のPOTSにおける予後
Mayo clinicで診断された13-18歳のPOTS症例で, 調査時に≥18歳の患者に手紙で経過を調査.
(J Pediatr 2016;173:149-53).
・502例を調査し, 返答があったのは172例(34%)
・診断〜調査までの期間は平均5.4±1.9年.
・完全に症状改善が19.2%
症状不変が8.7%
増悪経過が3.6%
改善傾向ありが51.2%
寛解, 再発の経過は15.7%